1. Enlaces del carbono
Cadenas carbonadas
¿Por qué hay tantos compuestos del carbono? El carbono tiene como estructura electrónica C: 2, 4, por lo que le faltan cuatro electrones para completar la segunda capa electrónica para alcanzar la estructura muy estable de gas noble (regla del octete).
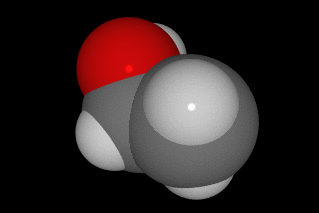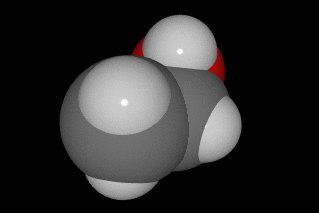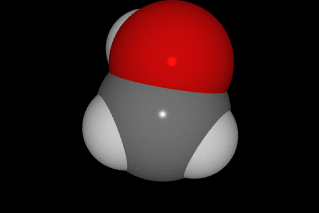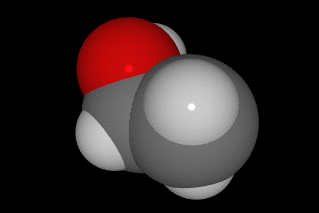
La forma de hacerlo es compartir cuatro electrones con otros átomos, de manera que la molécula más sencilla que forma es el CH4, metano. En las imágenes siguientes puedes ver la forma de compartir electrones y tres modelos moleculares diferentes.
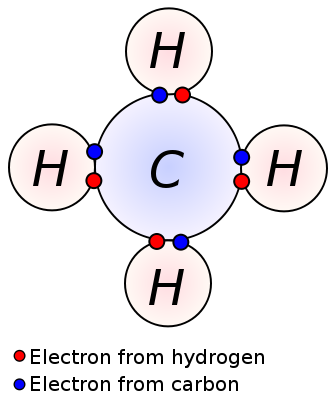 |
 |
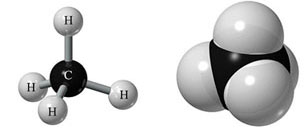 |
Pero si en lugar de unirse con un átomo de H lo hace con otro átomo de C, se forma una cadena de dos átomos de C, CH3-CH3, etano. Y si se sustituye otro H por C, se forma el CH3-CH2-CH3, propano. Es decir, se forman cadenas carbonadas, que pueden llegar a tener miles de átomos de carbono.
Estructuras electrónicas de Lewis
En la imagen puedes ver las estructures electrónicas de Lewis de varios compuestos del carbono. Sigue el método que ya conoces para obtenerlas: repartir en pares el número total de electrones que tienen todos los átomos de la molécula, de forma que se cumpla la regla del octete.
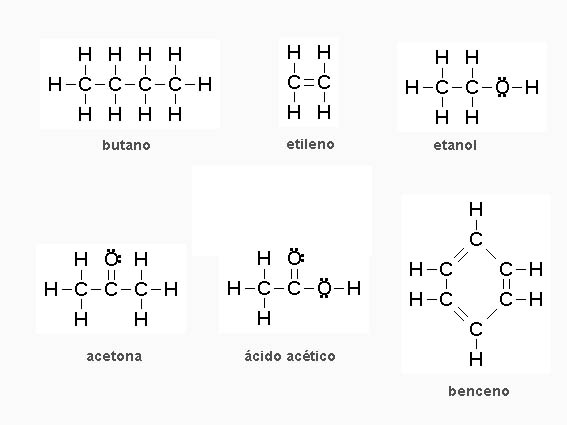
Las fórmulas de los compuestos del carbono
 |
 |
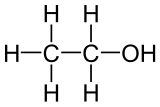
El etanol, o alcohol etílico, es la sustancia presente en las bebidas alcohólicas. Su fórmula molecular es C2H6O. Así escrita no aporta información sobre cómo están unidos los átomos en la molécula. Por esa razón se usa la fórmula semidesarrollada, que en este caso es CH3-CH2OH, en la que se indican los enlaces de la cadena, y la fórmula desarrollada, en la que se detallan todos los enlaces entre átomos, como puedes ver en la imagen junto con un modelo molecular animado.
Las fórmulas de los compuestos del carbono
Observa los modelos moleculares siguientes. Escribe sus fórmulas molecular y semidesarrollada.
Formas alotrópicas del carbono
Ya has visto que el carbono se presenta en la naturaleza en forma de diamante, formando una estructura gigante en la que solamente hay átomos de carbono unidos entre sí mediante enlaces covalentes. Como son enlaces muy intensos entre los átomos, son difíciles de romper, y el diamante es la sustancia más dura en la escala de Mohs. Su uso principal es tanto en joyería como en herramientas de corte.
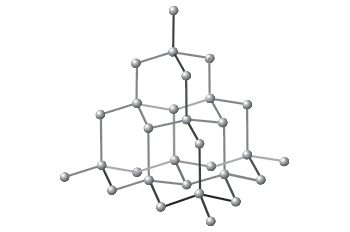 |
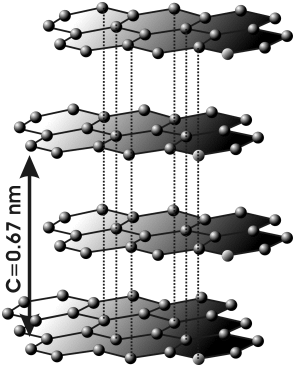 |
También se presenta en otra forma cristalina, el grafito, con anillos hexagonales de átomos de carbono, unidos por enlaces sencillos o dobles de forma alternada. Se forman láminas de anillos unidas entre sí por fuerzas más débiles, parecidas a las intermoleculares (cada lámina se puede considerar como una molécula muy grande), por lo que la dureza del grafito es menor. Se usa como conductor de la corriente eléctrica, para fabricar minas de lápiz, etc.
En los últimos años se han descubierto otras estructuras más complejas y que van a tener sin duda gran importancia en la tecnología: los fullerenos (más conocidos como futbolenos, debido a su forma de balón de fútbol), los nanotubos de grafito (láminas de grafito formando tubos) y, sobre todo, el grafeno (lámina monoatómica de grafito) cuyo uso va a revolucionar los sistemas informáticos y de comunicaciones en los próximos años.
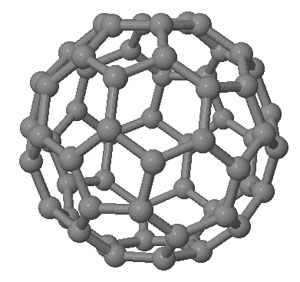 |
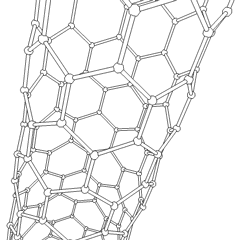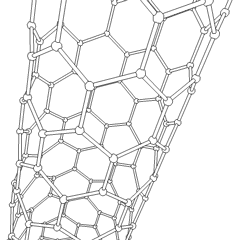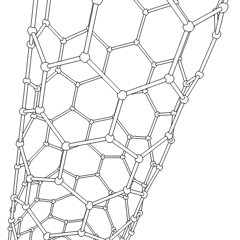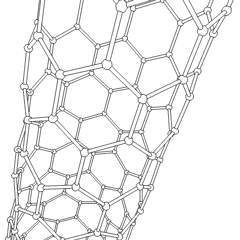 |
 |
 |
Y todavía hay que considerar que el carbono forma carbones (hulla, antracita, lignito y turba), materiales de origen natural formados a partir de materia orgánica, en los que los átomos de carbono no tienen una estructura cristalina definida, y contienen más o menos impurezas de otros elementos.
Su uso principal es como fuente de energía, ya desde la antigüedad y sobre todo desde la Revolución Industrial de finales del siglo XVIII.