Física y química 1º de BAC Tema 3. Química del carbono
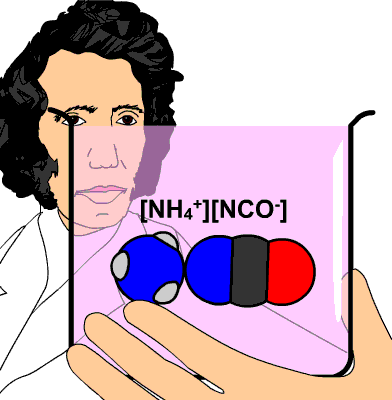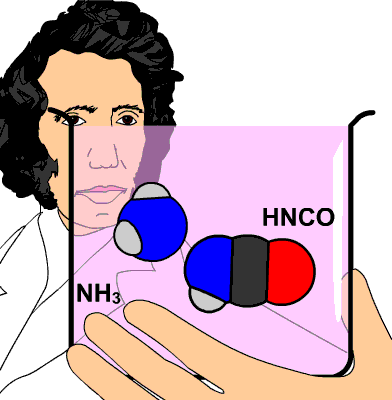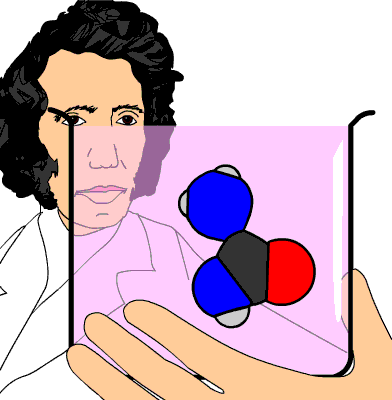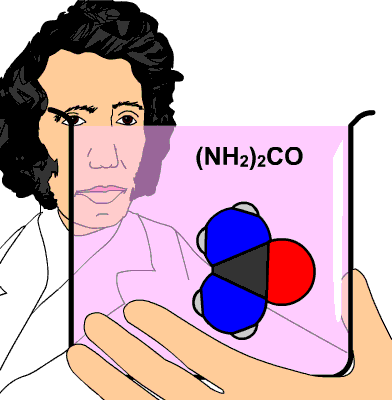 |
Aunque el nombre más adecuado es el de química de los compuestos del carbono, todavía se le sigue llamando química orgánica, porque desde hace siglos se pensaba que esos compuestos solamente existían y se podían producir en la materia viva. Es cierto que son sus principales constituyentes, pero cuando Whöler sintetizó la urea de forma accidental en 1828 a partir de compuestos inorgánicos, hubo que desechar ese principio "orgánico".
Todos tienen en común la existencia de cadenas de átomos de carbono y la presencia de unos pocos elementos más, básicamente hidrógeno, oxígeno y nitrógeno.
Forman moléculas desde muy pequeñas (CH4, metano, es la menor) hasta macromoléculas con masas molares de cientos de miles. Y su importancia y campos de aplicación carecen de límite conocido: no tienes más que pensar en los productos farmacéuticos, en los plásticos o en la secuenciación del ADN para ser consciente de ello.
En este tema vas a recordar algunos aspectos ya vistos en ESO, como los nombres y fórmulas de los compuestos del carbono, pero te centrarás en estudiar su obtención, propiedades y reactividad, además de en las reacciones de polimerización, en la industria petroquímica y en las aplicaciones de la química del carbono.
|
|
La urea en el cuerpo humano y en la industria
La urea, de fórmula CO(NH2)2, se produce cuando el cuerpo humano metaboliza las proteínas en el hígado. Se elimina por la orina (unos 30 g cada día).
Se prepara comercialmente a partir de amoniaco y de CO2, y se utiliza sobre todo en la fabricación de fertilizantes agrícolas (el 90%). La producción mundial de urea en 2008 fue de 146 millones de toneladas.
También se utiliza como estabilizador de explosivos, en la alimentación del ganado, en la producción de resinas, en la industria química para reducir los óxidos de nitrógeno, contaminantes que se producen en la combustión, y también en la fabricación de productos cosméticos.