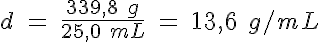3.3. ¿Qué líquido es?
 |
Identificando líquidos
Vas a medir la densidad de tres líquidos, etiquetados en sus frascos como A, B y C. Mide el volumen utilizando una bureta para cada líquido, que aprecia hasta 0,1 mL, y la masa mediante una balanza digital de 0,1 g.
En primer lugar, sitúa un vaso de precipitados en la balanza y deja la lectura a cero con la tecla de Tara. Colócalo debajo de la bureta y añade el volumen que desees al erlenmeyer (entre 10 y 20 mL). Vuelve a pesar el recipiente para saber la masa de líquido que contiene.
Vacía el vaso en el recipiente que hay junto a cada bureta y seca el interior del vaso con papel de filtro antes de cambiar de líquido.
Calcula las densidades de A, B y C, e intenta identificarlos utilizando la tabla de datos.
La tecla de tara de las balanzas
¿Qué función tiene la tecla de Tara en una balanza?
|
Hacer más rápida la pesada.
| |
|
Descontar la masa del recipiente en el que se encuentra la sustancia.
| |
|
Que la pesada sea más exacta.
| |
|
Evitar que los líquidos se evaporen.
|
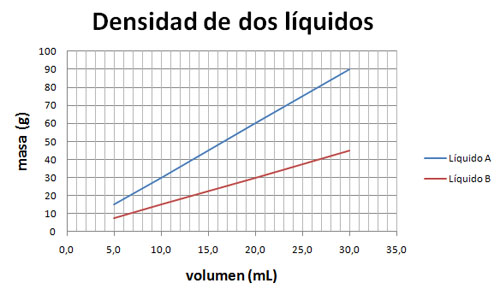 |
Gráficas y densidades
Observa la gráfica. Justifica cuál es el líquido más denso sin realizar ningún cálculo, y calcula después las densidades de A y de B.
 |
Propiedades del mercurio
El mercurio es el único metal líquido a temperatura ambiente. Es muy tóxico, ya que una vez que entra en el organismo por vía respiratoria, por ser muy volátil, no se elimina nunca. Por esa razón se ha prohibido su uso para fabricar termómetros clínicos de uso doméstico.
Tiene una enorme tendencia a formar bolitas, como puedes ver en la imagen. Forma meniscos en los tubos estrechos justo al revés que el agua, ya que baja por las paredes en lugar de subir.
Otra propiedad muy especial es su elevada densidad, que ahora vas a calcular. Para ello, añades mercurio a una probeta hasta los 25,0 mL exactos. La masa de la probeta es de 83,7 g estando vacía, y de 423,5 g cuando contiene el metal. Por tanto, la densidad del mercurio es:
|
1,36 g/mL
| |
|
13,6 g/L
| |
|
13,6 g/mL
| |
|
13,6 mL/g
|