Física y química 3º de ESO Tema 2. Estructura atómica de la materia
En la Física y química de 2º de ESO utilizaste el modelo de partículas de la materia para explicar algunas propiedades experimentales que puedes ver en tu entorno: un globo se hincha al inyectarle aire, una jeringa disminuye su volumen si la comprimes, etc. Te basabas en suponer que la materia está formada por partículas muy pequeñas, invisibles a simple vista, que se mueven desordenadamente, y más rápidamente cuanto mayor es la temperatura a la que se encuentra la sustancia. Para diferenciar las partículas de las sustancias, las representabas con símbolos diferentes, como círculos de colores diferentes, o con un punto, o una raya, o un aspa, etc.
|
|
 |
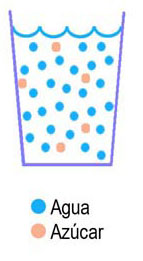 |
También aprendiste a diferenciar las sustancias puras de las mezclas: si en un recipiente hay una única sustancia, se trata de una sustancia pura, pero si hay más de una sustancia se dice que es una mezcla.
No es sencillo disponer de sustancias puras, ya que la materia se presenta como mezclas en la mayoría de los casos: el agua que hay en un vaso no es una sustancia pura, ya que lleva sustancias disueltas, que son imprescindibles para los organismos vivos; el hierro normalmente va mezclado con otras sustancias para mejorar sus características de resistencia y antioxidantes, como sucede en el acero; el butano de las bombonas es inodoro, pero se le añaden unas sustancias llamadas mercaptanos que tienen un olor muy intenso para detectar escapes de gas.
 |
¿En qué se diferencian las partículas de cada una de las sustancias puras conocidas?
Para dar respuesta a esa pregunta, hay que tener en cuenta otra característica experimental: a partir de hierro no hay formas de obtener una sustancia más sencilla que el hierro. Lo mismo sucede con el oxígeno, pero no con el agua: hay un procedimiento llamado electrolisis mediante el cual el agua se descompone en dos sustancias más sencillas, el oxígeno y el hidrógeno. Y al revés, combinando oxígeno e hidrógeno se puede obtener agua.
Es decir, parece ser que la partícula de agua no es indivisible, ya que da lugar a otras más pequeñas, las de oxígeno e hidrógeno. Las sustancias como el agua reciben el nombre de sustancias compuestas, mientras que las que son como el hierro o el oxígeno se llaman sustancias simples.
En la imagen puedes ver unas cuantas sustancias, alguna de las cuales posiblemente conozcas: ácido sulfúrico, azufre, agua, cinc, sulfato de cobre y benceno. El primero es en realidad una disolución de ácido sulfúrico en agua, y las demás son sustancias puras. El cinc y el azufre son sustancias simples porque a partir de ellas no se puede obtener otra más sencilla, mientras que a partir de ácido sulfúrico se puede obtener hidrógeno, oxígeno y azufre, a partir de sulfato de cobre, oxígeno, azufre y cobre, y a partir de benceno, carbono e hidrógeno, por lo que son sustancias compuestas.
En este tema profundizarás en la estructura de las partículas que forman las diferentes sustancias, desde el átomo a las partículas subatómicas fundamentales.
Sustancias simples y compuestas
Sustancia simple: a partir de ella no se puede obtener otra más sencilla.
Sustancia compuesta: a partir de ella se pueden obtener otras más sencillas, que en último extremo son sustancias simples.