4. Radiactividad
Fíjate en la imagen siguiente. Puedes ver que en la antigüedad se conocían unos pocos elementos: hasta el año cero solamente 9, y en los 1755 años siguientes otros 8 más.
Entre 1755 y 1855 se descubrieron 42. Desde ese momento y hasta 1935, otros 29. A partir de entonces, los elementos se han sintetizado en laboratorio, pues no existen en la naturaleza: 21 hasta 1990, y 5 más desde ese año hasta abril de 2010.

Cada vez resulta más difícil obtener nuevos elementos, ya que se
sintetizan solamente unos pocos átomos, que además son muy inestables,
descomponiéndose en otros elementos más estables en muy poco tiempo. Este proceso de transformación de unos elementos en otros emitiendo partículas y energía recibe el nombre de radiactividad.
Los elementos químicos a partir del plomo tienen isótopos radiactivos. El más conocido es el uranio, debido a su uso en la obtención de material para reactores de fisión en centrales nucleares y en bombas atómicas.
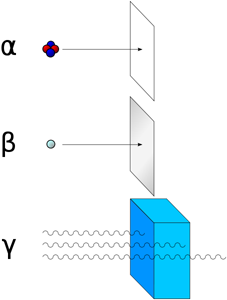 |
Tipos de radiactividad
Hay tres tipos de emisiones radiactivas:
Rayos alfa: son núcleos de helio, con carga positiva (no atraviesan una hoja de papel).
Rayos beta: son electrones, con carga negativa (no atraviesan una lámina de plomo de 1 mm de grosor).
Rayos gamma: es energía electromagnética (no atraviesan una lámina de acero de 15 cm de grosor).
 |
En 1896 Becquerel descubrió accidentalmente que algunos compuestos del uranio impresionaban las placas fotográficas envueltas en papel negro. Aunque probó con diferentes compuestos y condiciones, siempre sucedía lo mismo, por lo que concluyó que el origen estaba en el interior del átomo de uranio. El fenómeno se llamó radiactividad. Su estudio se debe al matrimonio Curie (Marie Curie es la única científica que tiene los premios Nobel de Física, en 1903, y de Química, en 1911), que encontraron otros elementos radiactivos como el torio y el radio.
Como has visto en la tabla anterior, hay elementos radiactivos naturales, pero se puede conseguir que haya radiactividad artificial, bombardeando núcleos atómicos con partículas de alta energía, de forma que los núcleos formados son inestables y se descomponen produciendo emisiones radiactivas.
La estabilidad de los núcleos
Si te detienes a pensar un poco, seguro que te parece muy raro que los núcleos sean estables, que no se descompongan. ¡Claro! El núcleo es extraordinariamente pequeño, y en él hay protones, partículas con carga positiva, que como están muy cerca, tienen una enorme tendencia a repelerse. ¿Por qué no sucede lo que la electrostática predice?
La razón consiste en que los neutrones que hay en el núcleo producen fuerzas atractivas que compensan las repulsivas, de forma que el núcleo es estable. Pero conforme aumenta el número de protones es más difícil que se produzca esa compensación de fuerzas, y llega un momento en que no se consigue, con lo que el núcleo se descompone en otros más estables, siendo radiactivo.