2. Modelos atómicos
A finales del siglo XIX se llegó a la conclusión de que el modelo de Dalton no era correcto, ya que se descubrieron partículas más pequeñas que el átomo más pequeño conocido, el de hidrógeno. Como se podían obtener a partir de átomos de diferentes elementos, se consideró que formaban parte de ellos y se les llamó partículas fundamentales.
Ya conoces dos de ellas, descubiertas al estudiar las interacciones eléctricas: el electrón (1897) y el protón (1918). Pero hay una tercera partícula, que resultó más difícil de descubrir, ya que no tiene propiedades eléctricas, el neutrón (1932). Aunque actualmente se conocen muchas más partículas (bosones, leptones, bariones, muones, etc), esas tres son suficientes para explicar la estructura de los átomos.
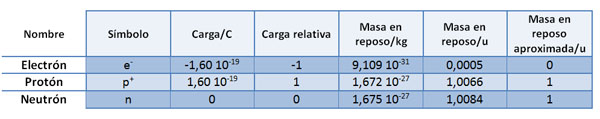
En la tabla siguiente tienes las características más importantes de las tres partículas fundamentales. Fíjate en que la carga de protón y electrón es de la misma magnitud pero sentidos contrarios, mientras que el neutrón carece de carga. En cuanto a las masas, las de protón y neutrón son muy parecidas, mientras que la del electrón es muy pequeña en comparación (casi 2000 veces menor).
 |
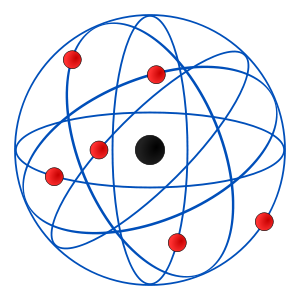
Modelo de Rutherford
Thomson propuso un modelo inicial de átomo en 1904, siete años después de descubrir el electrón, asimilando el átomo a una especie de sandía con pepitas dentro (electrones), sumergidos en una masa positiva (la pulpa), como puedes ver en la imagen. En conjunto, el átomo era eléctricamente neutro.
 |
 |
|
|
Pero en 1910 Rutherford realizó un experimento que obligó a modificar el modelo de Thomson: bombardeó una lámina de oro con partículas positivas a muy alta velocidad, y observó que aunque la mayoría pasaban a través de la lámina sin desviarse, algunas se desviaban y unas pocas incluso llegaban a retroceder.
Como puedes ver en el vídeo, explicó este hecho suponiendo que en el átomo había una zona central, muy pequeña y con carga positiva, llamada núcleo y que a su alrededor se encontraban los electrones, con carga negativa.
Es decir, los átomos son eléctricamente neutros, con los protones en el núcleo y los electrones en la corteza, girando en órbitas (modelo planetario).
Cuando se descubrieron los neutrones unos años después, se les asignó su lugar en el núcleo atómico.
Aunque hay modelos que se han tenido que desarrollar para explicar otros hechos experimentales más complejos (Bohr-Sommerfeld, Schrödinger), el modelo de Rutherford es suficiente para lo que necesitas saber en este momento.
¿Dónde se sitúan las partículas fundamentales?
Protones y neutrones: en el núcleo.
Electrones: en la corteza electrónica.
El tamaño de los átomos
 |
Cuando se dice que los átomos son muy pequeños, no se está dando una idea de lo pequeños que realmente son: considerando al átomo de hidrógeno como una esfera indeformable -como una bola de billar-, harían falta del orden de 2 1010 átomos en fila y en contacto uno con otro para alcanzar una longitud de un metro. ¡Y eso son nada menos que veinte mil millones de átomos!
Además, el núcleo es muy pequeño con respecto al átomo. Para tener una idea visual, se suele decir que si los límites del átomo pasasen por las porterías y las gradas de un campo de fútbol, el núcleo sería como un guisante situado en el centro del campo. Así que debes tener en cuenta que las imágenes que veas sobre los átomos no están a escala real: el radio del átomo es unas 10000 veces mayor que el del núcleo.