5. Representación de sustancias
La fórmula de las sustancias
Cuando ves escrito CO2, se hace referencia a la sustancia dióxido de carbono; si lees NaCl, se indica la sustancia cloruro de sodio, y si aparece C4H10 se representa la sustancia llamada butano. Son las fórmulas de las sustancias, en las que se detallan los elementos químicos que las forman, además de cuántos átomos o iones de cada uno hay.
En el caso del NaCl se han formado iones Na+ y Cl-, ya que el Na pierde el electrón que tiene en la capa más externa y lo gana el Cl, con lo que ambos iones tiene su capa más externa completa. Pero en el CO2 no se forman iones, sino que los átomos se unen mediante enlaces que se llaman covalentes, compartiendo electrones y dando lugar a una molécula, formada por tres átomos. En el caso del C4H10, la molécula está formada por 14 átomos, y hay moléculas formadas por miles de átomos, las macromoléculas.
Las propiedades de las sustancias formadas son muy diferentes (¡compara el dióxido de carbono, CO2, con la sal común, NaCl!) y es importante saber a qué se debe, porque así será posible diseñar sustancias que tengan las propiedades que nos interesen. Algunos de esos aspectos se abordan en la primera parte de la Física y Química de 4º.
Fórmulas de las sustancias moleculares
Indican el número de átomos de cada tipo que están unidos entre sí para formar una molécula. Así, la fórmula H2O indica que en la molécula de agua hay dos átomos de hidrógeno y uno de oxígeno unidos entre sí de alguna forma, pero con ningún otro átomo.
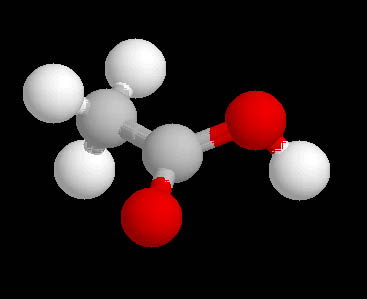
En la molécula de ácido acético, que es la sustancia que hay disuelta en agua en el vinagre, hay dos átomos de C, dos de O y cuatro de H, como puedes ver en la imagen (C gris, O rojo y H blanco).
 |
|
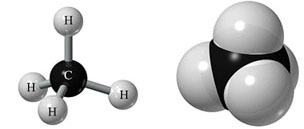
A la derecha puedes ver dos representaciones del metano, CH4, elaboradas con modelos moleculares del tipo de los que usarás en el laboratorio.
 |
 |
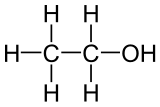
El etanol, o alcohol etílico, es la sustancia presente en las bebidas alcohólicas. Su fórmula molecular es C2H6O. Así escrita, no aporta información sobre cómo están unidos los átomos en la molécula. Por esa razón, se usa la fórmula semidesarrollada, que en este caso es CH3-CH2OH, y la fórmula desarrollada, en la que se detallan todos los enlaces entre átomos, que puedes ver en la imagen junto con un modelo molecular animado.
Fórmulas de las sustancias que forman estructuras gigantes
En el caso de que haya iones, las interacciones de atracción y repulsión entre ellos producen estructuras en las que los iones de un tipo quedan rodeados por los de otro y así sucesivamente, y que si se extienden lo suficiente en las tres dimensiones del espacio llegan a ser macroscópicas y visibles. Por esa razón se llaman estructuras gigantes o también cristales.
En ellas hay una enorme cantidad de iones positivos y negativos, de forma que la fórmula indica la proporción de iones que hay de cada tipo. Es decir, en el NaCl hay la misma cantidad de iones Na+ y Cl-, mientras que en el Na2S hay el doble de iones Na+ que S2-.
La estructura que se repite continuamente se suele llamar celda unidad. Fíjate en la imagen cómo se reproduce la estructura cúbica de la celda unidad del NaCl en un cristal de sal común.
 |
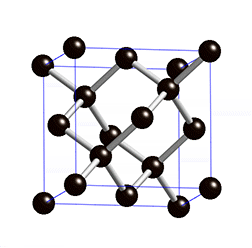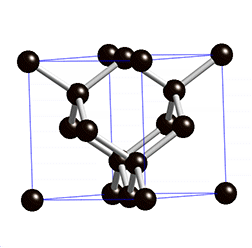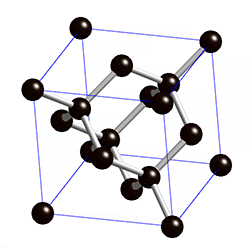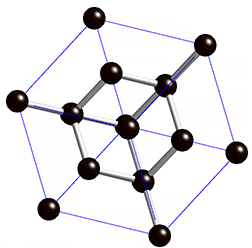 |
Estas estructuras gigantes también se dan en unas pocas sustancias formadas por átomos sin ionizar, como es el caso de la sílice (SiO2) y el carbono cristalizado como diamante, cuya celda unidad puedes ver en la imagen animada.
Tipos de partículas
-
Átomos, libres como en el gas helio (He) o formando estructuras gigantes como en el diamante (C) o en el hierro (Fe).
-
Iones, formando estructuras gigantes iónicas como en el NaCl, en el que hay iones Na+ e iones Cl-.
-
Moléculas, formadas por un número limitado de átomos unidos entre sí, que pueden ser iguales (O2) o distintos (HCl).
La fórmula del agua
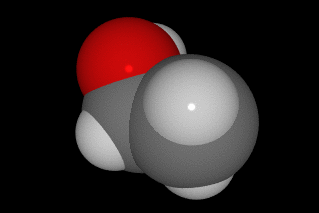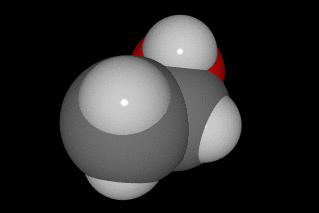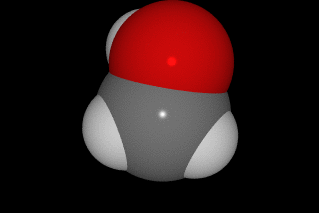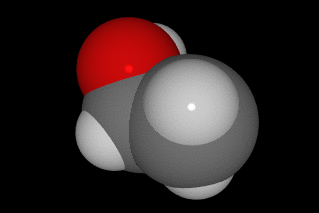
Casi todo el mundo sabe que la fórmula del agua es H2O, pero ¿cómo se determinó? El proceso se llama electrolisis, y consiste en hacer pasar corriente eléctrica a través de agua con un poco de ácido. Se produce la descomposición del agua en sus elementos, de manera que se forma el doble de volumen de hidrógeno (H2) que de oxígeno (O2), medidos en las mismas condiciones de presión y de temperatura.
 |
 |
Si reflexionas sobre las leyes de los gases, concluirás que si hay doble volumen significa que el número de partículas formado es doble. Es decir, en la molécula de agua hay dos átomos de hidrógeno y uno de oxígeno, como puedes ver en el modelo de la imagen.
La masa de las moléculas
Como una molécula es una agrupación finita de átomos (2, 3, 4, o el número de átomos que sea en cada caso), la masa de una molécula se calcula simplemente sumando las masas de los átomos que la forman, datos que están en la Tabla periódica.
Por ejemplo, la masa relativa de la molécula de agua, H2O, es de 18 (la del O es 16 y la del H 1, teniendo en cuenta que hay dos H), y su masa real de 18 u.
Calculando masas relativas
Calcula las masas relativas de las siguientes moléculas: CO2, N2O5, H2CO3, NH3 y CH3-CH2-CH3.