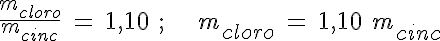2.1 La proporción de combinación
La proporción de combinación
 |
El cinc es un metal que reacciona con una disolución de ácido clorhídrico, produciendo cloruro de cinc, que queda disuelto, y gas hidrógeno, que se desprende formando burbujas, como puedes ver en la imagen.
¿Qué hay que hacer si se quiere saber la masa de cinc que ha reaccionado y la masa de cloruro de cinc formada? La reacción se producirá en una cápsula de porcelana en lugar de en un tubo de ensayo. En primer lugar, se mide en una balanza la masa de cinc que va a reaccionar. Después se añade disolución de HCl en exceso y se deja que se disuelva totalmente el cinc. Por último, se evapora a sequedad la disolución resultante, de manera que se forma un precipitado de cloruro de cinc, que es un sólido blanco. Volviendo a pesar una vez a temperatura ambiente, se puede saber por diferencia la masa de producto.
Utiliza el simulador siguiente, en primer lugar con la reacción entre el cinc y el ácido clorhídrico, y después cambiarás con los otros dos metales.
Añade la masa de cinc que quieras y anota su valor, así como la masa de producto formada una vez terminado el proceso experimental. Este último valor es la suma de la masa de cinc y la masa de cloro que ha reaccionado. Calcula la relación entre la masa de cloro y la de cinc. Repite la experiencia con diferentes masas de cinc y calcula la relación en todos los casos. ¿Cómo es esa relación?
Elige los otros dos metales y repite todo el trabajo.
Ley de las proporciones constantes
Cuando se combinan dos o más sustancias en una reacción química, lo hacen siempre en la misma proporción en masa. Esta proporción es constante entre cualquier reactivo y producto que intervenga en la reacción.
Disolución del cinc con HCl
Como has visto, el cinc es un metal que reacciona con una disolución de ácido clorhídrico, produciendo cloruro de cinc, que queda disuelto, y gas hidrógeno, que se desprende formando burbujas.
Si te fijas en las imágenes, verás que han reaccionado 2,9 g de cinc y se han formado 6,1 g de cloruro de cinc. La diferencia de masas se debe al cloro que se ha unido al cinc, por lo que han reaccionado 3,2 g de cloro.
 |
 |
En la tabla de datos siguiente tienes una serie de valores medidos en experiencias realizadas en el laboratorio utilizando una balanza que aprecia hasta 0,01 g:
|
mcinc / g |
mcloruro de cinc / g |
mcloro / g |
mcloro/mcinc |
|
2,05 |
4,25 |
||
|
2,13 |
4,49 |
||
|
2,31 |
4,89 |
||
|
2,42 |
5,08 |
||
|
2,49 |
5,31 |
||
|
2,78 |
5,78 |
||
|
3,28 |
6,86 |
La síntesis del amoniaco
Vas a utilizar el simulador para establecer cuál es la relación de combinación entre nitrógeno e hidrógeno para obtener amoniaco.
Vas a hacer cinco mezclas iniciales diferentes (por ejemplo, 10 g de cada una de las dos sustancias), y obtendrás la cantidad de cada una de las tres sustancias en la mezcla final. Comprueba que se conserva la masa y observa cuál es el reactivo en exceso. Debes anotar los valores en la tabla y calcular cuánto valen en cada caso las tres proporciones de combinación que se indican.
¡ATENCIÓN! Si estás utilizando este tema online, pulsa aquí para ver el simulador (no te aparecerá en la pantalla). Si estás en modo local, trabaja directamente sobre el simulador.
| N2ini (g) | H2ini (g) | N2 (g) | H2 (g) | NH3 (g) | N2/H2 | NH3/N2 | NH3/H2 |
¿Puedes saber ahora la composición de la mezcla final cuando mezclas 10 g de hidrógeno con 80 g de nitrógeno? Ten en cuenta que este resultado no lo puedes obtener con el simulador, ya que no permite masas mayores de 50 g.