2.2 Aplicando las leyes
Fíjate en la tabla de datos siguiente, que corresponde a una reacción química entre dos sustancias, A y B, que dan lugar a una tercera, C. Se trata de que determines los valores de las masas desconocidas -x, y, z- aplicando las leyes de conservación de la masa y de las proporciones constantes.
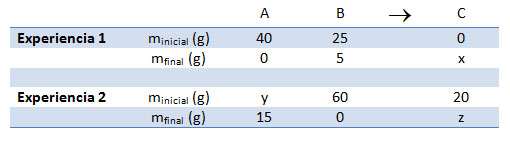
Valor de x. Como en la experiencia 1 se cumple la conservación de la masa y hay 65 g de sustancia antes de la reacción (40 g de A y 25 g de B), también debe haber 65 g después de la reacción: como de A no sobra nada y de B sobran 5 g (reactivo en exceso), de C se han tenido que forman 60 g. Es decir, x = 60 g, ya que no había C inicialmente
Además, puedes saber la proporción de combinación entre A y B: si te fijas, verás que han reaccionado 40 g de A con 20 g de B (los 25 g que había al principio menos los 5 g que hay en exceso).
Valor de y. Ahora trabajas con datos de la segunda experiencia con la misma reacción. Ésta es la parte más complicada. Fíjate en que de B hay 60 g que reaccionan totalmente. ¿Con qué masa de A reaccionarán? Para determinarla, debes aplicar la porporción de combinación anterior, que es constante:
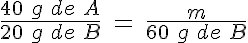
Despejando y resolviendo, m = 120 g de B. Pero como deben sobrar 15 g de A, inicialmente debe haber 135 g de A. En resumen, y = 135 g.
Valor de z. Ahora vuelves a aplicar la conservación de la masa: inicialmente hay (135 + 60 + 20) g, y al final también (15 g + z). Resolviendo, z = 200 g. También puedes darte cuenta de que como han reaccionado 120 g de A con 60 g de B, han desaparecido 180 g de reactivos, con lo que se ha tenido que formar la misma masa de productos; es decir, 180 g de C. Y como ya había previamente 20 g, al final habrá 200 g de C.
Esquemas de reacción
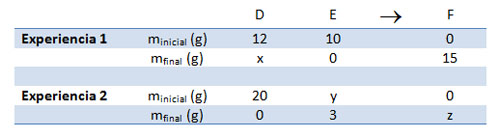
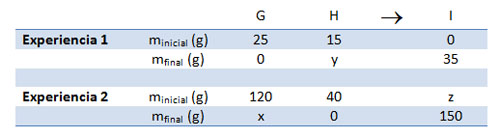
Resuelve los dos esquemas de reacción siguientes, utilizando las leyes de conservación de la masa y de las proporciones de combinación constantes. Justifica cómo determinas cada uno de los valores incógnita (x, y, z).
 |
 |