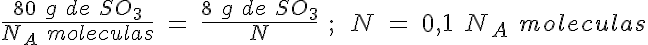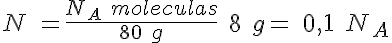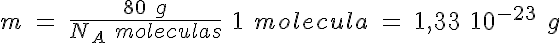2. La cantidad de sustancia
 |
El tamaño de los átomos, moléculas o iones es extraordinariamente pequeño, y por eso hay una cantidad enorme en una masa tan pequeña como un gramo (¡nada menos que 9,48 1021 átomos de Cu en un gramo de Cu!). Precisamente por ser tan pequeños es imposible aislarlos, contarlos o pesarlos.
Fíjate en que cuando se estudian las transformaciones de sustancias, las reacciones químicas, se está hablando continuamente de partículas (una molécula de oxígeno reacciona con dos de hidrógeno para formar dos moléculas de agua). Pero en el laboratorio no podemos contar partículas: lo único que podemos es pesar sustancias y medir volúmenes.
Precisamente se define la magnitud cantidad de sustancia para poder relacionar masas o volúmenes de sustancias, que se pueden medir a escala macroscópica, con el número de partículas que hay en esa cantidad, que es lo que interesa saber desde el punto de vista de las reacciones químicas y que, como ya sabes, no es posible contar.
masa ↔ cantidad de sustancia ↔ número de partículas
De las siete magnitudes fundamentales que tiene el Sistema Internacional es la única magnitud química, porque las otras seis con físicas (longitud, masa, tiempo, temperatura, intensidad de corriente eléctrica e intensidad luminosa).
La cantidad de sustancia
Su unidad es el mol, que se define como "la cantidad de sustancia de un sistema que contiene tantas entidades elementales como átomos de carbono hay en 0.012 kg de carbono-12" (IUPAC 1967, BOE de 3-11-1989). El término entidad elemental se refiere a partículas, que pueden ser átomos, moléculas o iones.
La magnitud cantidad de sustancia se simboliza por n, mientras que su unidad mol no tiene abreviatura, y se escribe mol.
¿El número de moles?
De esta forma, se puede decir n(agua)= 2 mol, que significa que la cantidad de sustancia de agua es de 2 mol (ó 2 moles).
Es incorrecto decir que el número de moles es 2. Por ejemplo, cuando se mide la longitud de una mesa se escribe l(mesa)= 1,5 m, que significa que la longitud de la mesa es de 1,5 m, no que el número de metros de la mesa sea 1,5. Sin embargo, es extraordinariamente frecuente encontrar la expresión "el número de moles es" en lugar de "la cantidad de sustancia es".
La masa molar y la masa de una partícula
 |
La masa molar de una sustancia (M) es la masa en gramos que tiene un mol de esa sustancia. Se mide en g/mol.
Es muy fácil saber su valor, ya que M concide numéricamente con la masa relativa de la partícula, aunque tiene un significado diferente: si la masa relativa del CO2 es 44, su masa molar M es 44 g/mol.
Y como en un mol de cualquer sustancia hay el número de Avogadro de partículas, NA (6,023 1023), que tienen una masa de M (masa molar), es sencillo calcular la masa de una partícula de la sustancia: no tienes mas que hacer el cociente entre la masa total y el número de partículas por mol.
Para calcular masas y números de partículas
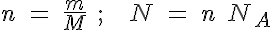 |
n=cantidad de sustancia m=masa de sustancia M=masa molar N=número de partículas NA=número de Avogadro |
Debes tener mucho cuidado a la hora de aplicar estas fórmulas, porque si no tienes las ideas claras, puedes confundirte fácilmente: fíjate en que los símbolos de las magnitudes son letras ene y eme, mayúsculas o minúsculas, y hasta con subíndices: es más recomendable utilizar proporciones o factores de conversión para determinar las magnitudes que necesites
Lo fundamental que debes tener presente siempre es que en un mol de cualquier sustancia hay NA partículas (número de Avogadro) y su masa es de M gramos (masa molar).
Medidas de masa en el agua
 |
La masa relativa del agua, mr, es 18, y significa que una molécula de agua tiene una masa 18 veces mayor que la masa unidad. Mientras no se sepa cuál es el valor de esa masa unidad, no hay forma de saber la masa de la molécula de agua, que se indica como 18 u, donde u es la masa real de la unidad de masa atómica.
Pero como ya se sabe que la masa unidad es de 1,667 10-24 g, la masa real de la molécula de agua es de 18 veces 1,667 10-24 g. Este número no tiene ninguna utilidad en Química desde el punto de vista práctico, porque no se puede disponer de moléculas de agua aisladas.
Si en un vaso echas el número de Avogadro de moléculas de agua, ¿qué masa de agua tienes? Evidentemente, será la masa molar, es decir, la masa de una molécula multiplicada por el número de moléculas que hay en un mol de sustancia:
18 1,667 10-24 g/molécula 6,023 1023 moléculas/mol = 18 g/mol
Fíjate en que el resultado numérico es 18. Es decir, el número de la masa relativa se mantiene en la masa real y en la masa molar, aunque tiene significados diferentes en los tres casos.
| mr(H2O)= 18 |
m(H2O)= 18 u |
M(H2O)= 18 g/mol |
¿Por qué el número de Avogadro es 6,023 1023?
Para mantener el mismo número para la masa relativa, la masa real y la masa de un mol (masa molar, M), aunque el significado de las tres magnitudes es diferente.
Su valor, 6,023 1023, es exactamente el inverso de la unidad de masa atómica, 1,669 10-24 g.
La masa de una molécula de SO3
El SO3 es uno de los gases más contaminantes y tóxicos que hay en la atmósfera. Se produce en la combustión de diferentes sustancias que contienen pequeñas cantidades de azufre.
Calcula cuántas moléculas hay en 8 g de SO3, así como la masa de una de esas moléculas.
 |
Lingotes de plata
Determina cuántos átomos de plata hay en un lingote de plata de 1000 g.
¿Es muy grande 6,023 1023?
El número de Avogadro es enorme. Para que te hagas una idea de lo grande que es,
supón que cada uno de los 7000 millones de habitantes de la Tierra es capaz de
contar una bola por segundo: para que en total lleguen a contar el número
Avogadro de bolas, harían falta ¡2.73 millones de años sin detenerse!