1. Leyes de las reacciones químicas
Cuando se produce una reacción química, se observa experimentalmente que disminuye la masa que hay de unas sustancias, los reactivos, y aumenta la de otras, los productos.
Ahora vas a trabajar precisamente con esas cantidades. ¿Qué masa desaparece de reactivos? ¿Qué masa se forma de productos? ¿Hay alguna relación entre esas masas?
Lavoisier ya estableció esa relación en su Tratado elemental de Química (1789), después de una gran cantidad de medidas experimentales.
Ley de conservación de la masa (Lavoisier, 1789)
Cuando se produce una reacción química, la masa que se forma de productos es la misma masa que desaparece de reactivos: las sustancias se transforman unas en otras, pero la masa total no cambia.
La proporción de combinación
Utiliza el simulador siguiente con la reacción entre el cinc y el ácido clorhídrico.
Añade la masa de cinc que quieras y anota su valor, así como la masa de producto formada una vez terminado el proceso experimental. Este último valor es la suma de la masa de cinc y la masa de cloro que ha reaccionado. Calcula la relación entre la masa de cloro y la de cinc. Repite la experiencia con diferentes masas de cinc y calcula la relación en todos los casos. ¿Cómo es esa relación?
Puedes trabajar con cualquiera de los otros dos metales para confirmar tus resultados.
Ley de las proporciones constantes
Cuando se combinan dos o más sustancias en una reacción química, lo hacen siempre en la misma proporción en masa (proporción constante).
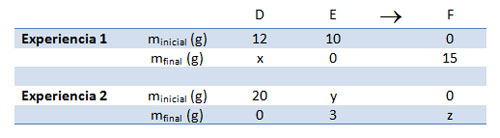
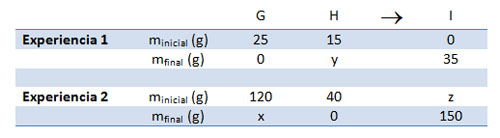
Aplicando las leyes de las reacciones químicas
Resuelve los dos esquemas de reacción siguientes, utilizando las leyes de conservación de la masa y de las proporciones de combinación constantes. Justifica cómo determinas cada uno de los valores incógnita (x, y, z).
 |
 |