5. Ácidos y bases
Los ácidos y las bases son sustancias muy habituales, que se diferencian en función de sus propiedades experimentales (sabor, reactividad, capacidad para colorear disoluciones, ...).
Modelos ácido-base
El modelo inicial y más sencillo para caracterizar estos tipos de sustancias es el de Arrhenius: ácidos son aquellas sustancias que producen iones H+ en disolución acuosa, mientras que las bases producen iones OH-. Por tanto, son procesos en disolución.
H2SO4 (aq) → SO42- (aq) + 2 H+ (aq)
NaOH (s) → Na+ (aq) + OH- (aq)
La reacción de neutralización
Cuando un ácido reacciona con una base, sus efectos se anulan y se dice que se neutralizan. Si las cantidades que se mezclan son las estequiométricas (no sobra ácido ni base), la disolución resultante es neutra.
H2SO4 (aq) +2 NaOH (s) → SO42- (aq) + 2 Na+ (aq) + 2 H2O
En realidad, la reacción de neutralización es H+ (aq) + OH- (aq) → H2O.
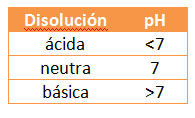
Medida de la acidez de las disoluciones
 |
Se utilizan indicadores, que son sustancias que toman un color diferente según sea la acidez de la disolución. El tornasol toma color rojo en disoluciones ácidas y azul en básicas.
Una medida cuantitativa la da el pH de las disoluciones, que es de 7 para disoluciones neutras, menor para disoluciones ácidas y mayor para disoluciones básicas. Una disolución es ácida si su pH es menor de 7, y más ácida cuanto menor sea el pH. Es un valor relacionado con la concentración de iones H+ que hay en una disolución.
Disoluciones ácidas y básicas
Utiliza el simulador siguiente para clasificar las disoluciones en ácidas o básicas.
 |
El papel pH
Se trata de un papel absorbente que se fabrica impregnándolo en indicador universal. De esta forma, cuando se moja con una disolución, toma el color del indicador para el pH de la disolución, que se puede saber sin más que comparar el color del papel con el de la escala.
Rojo: pH ácido Azul: pH básico