6.1 Cambios de estado
 |
Ya sabes que si comunicas energía en forma de calor a una sustancia, además de aumentar su temperatura puedes llegar a producir cambios de estado, cuyos nombres puedes ver en la imagen.
También sabes que los cambios de estado están relacionados con la intensidad de las fuerzas que mantienen unidas las partículas de una sustancia.
En el estado sólido las partículas están muy unidas entre sí, lo que les obliga a permanecer en posiciones casi fijas, salvo pequeñas oscilaciones. En el estado líquido las fuerzas entre ellas son menores, por lo que se mueven unas con respecto a otras, deslizándose pero manteniendo bastante proximidad entre ellas. Cuando las fuerzas son prácticamente nulas, las partículas se mueven independientemente unas de otras, alejándose y encontrándose la sustancia en estado gaseoso.
Observa en las siguientes simulaciones el calentamiento del agua.
Fíjate como cuando el agua está cambiando de estado de agregación la temperatura permanece constante, empleándose toda la energía que se comunica en forma de calor en la modificación de las fuerzas que unen las moléculas de agua para pasar a un nuevo estado (de sólido a líquido o gaseoso).
Las características de cada uno de esos estados se deben a la existencia de interacciones diferentes entre las partículas de la sustancia. Cuando hay un cambio de estado se modifican la uniones entre las partículas en lugar de aumentar la temperatura, de manera que la sustancia presenta un estado físico diferente, con las partículas más alejadas al pasar de sólido a líquido o de líquido a gas.
Por este motivo, la cantidad de sustancia que cambia de estado depende de la cantidad de calor que se le comunica y del tipo de sustancia. Fíjate en la expresión siguiente, en la que se recogen ambos factores, siendo L el calor latente de cambio de estado, característico de cada sustancia.
Q = mL

Cambios de estado y equilibrio térmico
Si tienes que considerar el caso de la búsqueda del equilibrio térmico entre cuerpos en diferente estado físico, debes tener en cuenta los cambios de estado que se produzcan. Este sería, por ejemplo, el caso de un bloque de hielo en un recipiente con agua caliente.
En fenómenos de esta naturaleza tienes que considerar que el calor ganado o perdido no tiene por qué emplearse únicamente en variar de temperatura, sino que también puede haber un cambio de estado de alguna de las sustancias implicadas.
El principio de conservación de la energía seguirá siendo válido, pero al calcular la energía absorbida o perdida por cada cuerpo debes contar con la que se ha empleado en el cambio de estado.
En la imagen puedes ver todos los intercambios energéticos que se pueden producir, junto con el calor implicado en cada caso.
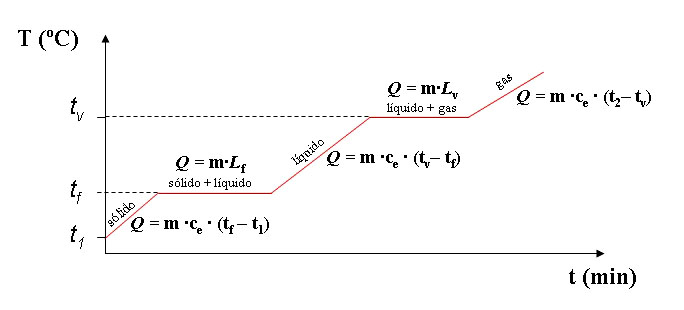 |
Fundiendo hielo
Determina la cantidad de energía en forma de calor que hay que comunicar a un iceberg de 1200 kg que está a -20 ºC para fundirlo y transformarlo en agua a 10 ºC.
| |
Disparando al hielo
Se dispara horizontalmente un proyectil de aluminio de 15 g de masa sobre un bloque de hielo que está a 0 ºC. Cuando impacta lo hace a 100 m/s y se queda empotrado en el hielo. Si el 90% de la energía de la bala se invierte en fundir hielo ¿cuánto hielo se transformará en agua líquida?