6. Efectos del calor
Cuando un cuerpo absorbe o pierde energía térmica en forma de calor se modifica:
- su temperatura, que aumenta o disminuye.
- su estado físico, en la secuencia sólido - líquido - gas o al revés.
- su tamaño, dilatándose o contrayéndose.
Aumento de temperatura
El calor específico de una sustancia se define como la cantidad de energía en forma de calor que hay que suministrar a un kg de dicha sustancia para aumentar su temperatura un grado; sus unidades son J kg-1 K-1 en el Sistema Internacional.
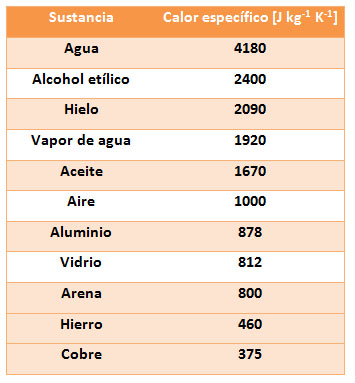
El calor específico es una propiedad característica de las sustancias, ya que depende de las fuerzas que existen entre sus partículas. Además, para una misma sustancia varía según el estado físico. Observa en la tabla los calores específicos de distintas sustancias. Ten en cuenta que un calor específico alto significa que se necesita mucha energía en forma de calor para incrementar la temperatura de la sustancia.
La relación entre la cantidad de calor (Q) que se comunica a un cuerpo y el cambio de temperatura (ΔT) que alcanza es:
Ten en cuenta que la variación de temperatura ΔT es la misma medida en ºC o en K.
- Si el cuerpo absorbe energía en forma de calor, Tf > Ti y Q > 0
- Si el cuerpo desprende energía en forma de calor, Tf < Ti y Q < 0
Siempre que dos cuerpos intercambian energía en forma de calor, como consecuencia del principio de conservación de la energía la energía perdida por uno de ellos (negativa) es la misma que la ganada por el otro (positiva).
Si pones en contacto dos sustancias a diferente temperatura inicial (T1i menor que T2i), utilizando la expresión en función del calor específico y siendo T la temperatura de equilibrio, intermedia entre las dos temperaturas iniciales, puedes escribir que:
Como la sustancia 1 se calienta, T-Ti1 es positivo y absorbe energía en forma de calor, mientras que la sustancia 2 la cede y se enfría (T-Ti2 es negativo).
Reflexionando sobre el calor específico
a) ¿Cuál de entre los líquidos que aparecen en la tabla de datos es el que menos variaciones de temperatura experimenta por intercambios de energía en forma de calor?
b) ¿Qué metal de los que aparecen en la tabla se calienta más por acción del calor?
La temperatura de la mezcla
Utilizando la simulación siguiente puedes realizar mezclas de diferentes cantidades de agua con temperaturas iniciales distintas y determinar cuál es su temperatura final. Fíjate en el caso particular de mezclar cantidades iguales de agua (¡la temperatura de equilibrio es la media de las iniciales!).
Mezclando agua a dos temperaturas
Tienes 40 mL de agua a 80ºC y le tienes que añadir agua a 30 ºC para tener una mezcla a 50 ºC. ¿De qué cantidad de agua dispondrás a 50 ºC?
Utiliza el simulador, pero también debes resolver el problema matemáticamente.
Determinación experimental de calores específicos
Utiliza el simulador para determinar el calor específico de las seis sustancias. Fíjate en que puedes modificar la masa de la sustancia, que en todos los casos calientas a 100 ºC y la añades a 200 mL de agua. Ten en cuenta que el calor específico del agua es de 4,18 J g-1 ºC-1.
 |
El calor específico del amianto
El amianto es un material que se ha utilizado como aislante térmico en la construcción de edificios desde 1880. En España se prohibió su uso en 2002, debido a los riesgos para la salud que supone la inhalación de fibras de amianto. Teniendo en cuenta el uso que se le ha dado, justifica cómo debe ser el valor de su calor específico.
| |
Café con leche
¿Cuál será la temperatura final de equilibrio cuando 10 g de leche a 10°C se agregan a 60 g de café a 90°C? Puedes suponer que los calores específicos de los líquidos son iguales al del agua. Asimismo, desprecia el calor absorbido por el recipiente.
Calentando un termo
Un termo vacío de 400 g está a 20 ºC. Cuando se le añaden 30 g de agua a 90 ºC alcanza una temperatura de 30 ºC. Calcula el calor específico del material de que está hecho el termo. ¿Interesa que ese valor sea alto o bajo?