9.5 Las propiedades del agua
El agua es sin duda la sustancia más conocida y de uso más habitual. Se sintetizó por primera vez en 1781 y su fórmula se estableció en 1805, pero su estructura (longitudes y ángulos de enlace) no se determinó hasta 1956, utilizando técnicas espectroscópicas.
Se trata de una molécula de masa pequeña, por lo que las fuerzas dispersivas son débiles. Sin embargo, forma puentes de hidrógeno, de manera que las fuerzas intermoleculares totales son intensas.
Sus puntos de fusión y ebullición son más elevados de lo que se podría esperar. Si se analizan los datos de puntos de cambios de estado de los hidruros H2S, H2Se y H2Te, su punto de ebullición debería ser de unos -50 ºC. Sin embargo, afortunadamente a temperatura ambiente es líquida.
|
|
Su densidad en estado sólido es de 0,91 g/cm3. Las moléculas de agua se ordenan formando cristales con estructuras más o menos abiertas (¡hay muchos tipos de hielo!), pero la densidad es menor que en estado líquido. Este hecho justifica que el hielo flote en agua, aislando la capa inferior de agua, que no se congela y permite el mantenimiento de la vida aún en condiciones extremas.
Su calor específico es muy alto, de 4180 J/kg ºC. Es decir, para que el agua aumente su temperatura necesita absorber una gran cantidad de energía en forma de calor, por lo que presenta una apreciable resistencia a cambiar su temperatura, tanto para calentarse como para enfriarse (se utiliza como líquido
refrigerante en los radiadores de los coches y como calefactor en los sistemas de calefacción).
Ese hecho justifica que el clima costero sea más uniforme que el continental, con variaciones térmicas menos acusadas.
De forma similar, tiene efecto termorregulador: cuando se suda, el líquido que hay sobre la piel se evapora, proceso que necesita una gran cantidad de energía, que extrae de la propia energía térmica de la piel. El efecto producido es la disminución de temperatura: se suda para refrescarse (los perros no tiene glándulas sudoríparas, y no sudan, pero la termorregulación la realizan a través de la lengua; fíjate que en verano siempre están jadeando con la lengua afuera).
 |
En cuanto a su capacidad disolvente, ya has visto sus características y el mecanismo de disolución. Fíjate ahora con más detalle en la forma de disolver sal común. Los iones pasan del cristal a la disolución, y cuando se introducen los electrodos de una pila, se enciende la bombilla que lleva conectada.
Pero cuando se añade una sustancia apolar al agua, la mezcla no se realiza. Por ejemplo, al mezcla agua y gasolina, como se ve en la simulación, queda una fase acuosa y otra orgánica flotando sobre ella, al ser menos densa. Como no hay interacciones entre el agua y la gasolina, no se mezclan.
Precisamente este hecho tiene una gran influencia en la capacidad limpiadora del agua: no sirve para grasas y sustancias apolares en general. Los detergentes son sustancias con un extremo polar y otro apolar, de forma que por el apolar rodean a partículas de grasa, mientras que el polar, exterior, interacciona con las moléculas de agua (¿has oído en televisión la expresión de "el milagro antigrasa"?).
|
|
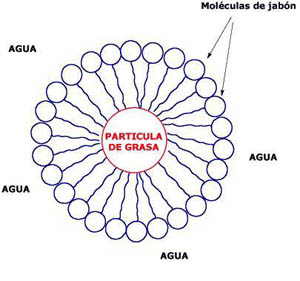 |
Si te fijas en la imagen anterior, verás que las moléculas de jabón tienen un extremo que interacciona con el agua (hidrófilo) y otro que no lo hace, pero que sí interacciona con las moléculas de grasa (hidrófobo).
|
|
|
Las fuerzas dispersivas en el alcohol son mayores que en el agua.
| |
|
Las interacciones entre moléculas de agua y alcohol son mayores que entre las de agua y entre las de alcohol.
| |
|
Entre moléculas de alcohol no se forman puentes de hidrógeno.
|
¿Procesos físicos o químicos?
La disolución tanto de sustancias iónicas como moleculares en agua son procesos físicos, ya que al evaporar el disolvente se vuelve a recuperar la sustancia disuelta (sal o azúcar en los casos anteriores).
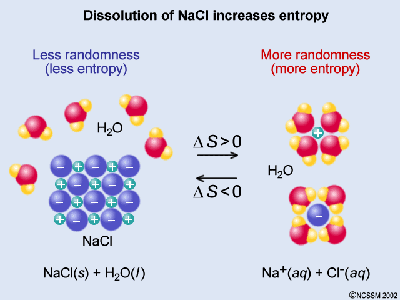 |
Disolución de sólidos iónicos
Observa la imagen y justifica a qué se debe que en el proceso de disolución de una sustancia iónica se produzca un aumento de entropía.