2.4 Reacciones redox
 |
Las reacciones de oxidación-reducción (redox) implican la transferencia de electrones entre especies químicas. Se llaman también reacciones de transferencia de electrones ya que la partícula que se intercambia es el electrón.
En una reacción de oxidación-reducción tienen lugar los dos procesos a la vez, la oxidación y la reducción.
Oxidación y reducción
La oxidación es el proceso en el cual una especie química pierde electrones y su número de oxidación aumenta.
La reducción es el proceso en el cual una especie química gana electrones y su número de oxidación disminuye.
Fíjate en una reacción redox característica: la oxidación del aluminio, que reacciona con el oxígeno para formar óxido de aluminio:
4 Al + 3 O2 → 2 Al2O3
En el transcurso de esta reacción, cada átomo de aluminio pierde tres electrones para formar un ión Al3+:
Al → Al3+ + 3 e-
Y cada molécula de O2 gana cuatro electrones para formar dos iones O2-:
O2 + 4 e- → 2 O2-
Los electrones que libera el Al son precisamente los que gana el O. Es decir, la oxidación y la reducción se producen a la vez, y se ha de intercambiar el mismo número de electrones, por lo que hacen falta 4 átomos de Al y 6 de O (en 3 moléculas de O2):
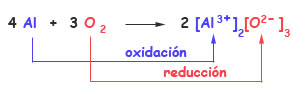
El aluminio cede electrones y el oxígeno los gana. El aluminio actúa como agente reductor, se oxida (su número de oxidación pasa de 0 a +3) cediendo tres electrones, mientras que el oxígeno actúa como agente oxidante, se reduce (su número de oxidación pasa de 0 a -2) ganando dos electrones.
Oxidantes y reductores
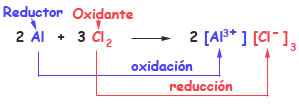
En la reacción del aluminio con el cloro para formar cloruro de aluminio, ¿cuál es el oxidante y cuál es el reductor?
Las reacciones de combustión
 |
Una reacción de combustión es un tipo de reacción redox en la que un material combustible se combina con el oxígeno del aire para formar, entre otros productos, dióxido de carbono con desprendimiento de energía (reacción exotérmica).
Un ejemplo típico es la reacción del carbono con el oxígeno:
C + O2 → CO2
En esta reacción, el carbono cede electrones y el oxígeno los gana. El carbono se oxida y su número de oxidación pasa de 0 a +4 cediendo cuatro electrones, mientras que el oxígeno se reduce y su número de oxidación pasa de 0 a -2 ganando dos electrones.
Normalmente, en una reacción de combustión se combina el oxígeno con un hidrocarburo para formar dióxido de carbono y agua. Un ejemplo es la combustión del butano:
2 C4H10 + 13 O2 → 8 CO2 + 10 H2O
Otro ejemplo es la respiración de los seres vivos, en la que se produce CO2 y H2O a partir del oxígeno del aire y la glucosa, mediante un proceso que se puede resumir en la ecuación:
 |
Aluminotermia: soldadura de raíles
Cuando se hace reaccionar el aluminio con un óxido metálico, se produce una reacción conocida como termita o aluminotermia. El proceso fue descubierto por Hans Goldscmidt a finales del siglo XIX, y en la actualidad se utiliza en soldadura.
La soldadura aluminotérmica es un procedimiento utilizado en carriles de vías férreas y en otras estructuras. Consiste en provocar la reducción del óxido de hierro (III) por el aluminio, proceso fuertemente exotérmico, para obtener hierro y óxido de aluminio.
Fe2O3 + 2 Al → Al2O3 + 2 Fe
La reacción de la termita
En la reacción de la termita (aluminotermia), Fe2O3 + 2 Al → Al2O3 + 2 Fe, se cumple que:
El aluminio se oxida.
| |
El hierro se oxida.
| |
El número de oxidación del aluminio aumenta.
| |
El número de oxidación del hierro aumenta.
| |