4.6 Estados físicos y cambios de estado
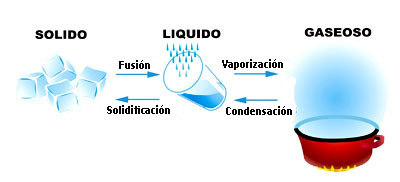 |
El modelo de la materia propuesto lo has aplicado tanto a sólidos como a líquidos y a gases. Ahora es el momento de utilizarlo para interpretar los cambios de estado.
En la imagen tienes hielo, agua líquida y vapor de agua. El hielo funde a 0 ºC y el agua entra en ebullición a los 100 ºC, como ya sabes, y también puede producirse la condensación del vapor y la solidificación del agua.
Observa en la siguiente simulación cómo se producen estos cambios de estado desde el punto de vista experimental, fijándote especialmente en cómo varía la temperatura durante el proceso: permanece constante mientras se produce el cambio de estado.
Ahora vas a ver una simulación que te permitirá entender el proceso desde el punto de vista del modelo de partículas. Pulsa el botón de encendido y observa lo que sucede.
Fíjate en que la energía en forma de calor que suministra el mechero bunsen sirve para calentar la sustancia, con lo que las partículas se van moviendo más deprisa y alejándose entre ellas.
Para explicar la fusión del hielo al calentar, las partículas se separan un poco, con lo que ganan libertad de movimientos, deslizándose unas sobre otras, tal y como se ve en la simulación. ¡Pero para conseguirlo hay que vencer las atracciones entre partículas en el estado sólido!
Una vez que se alcanza el punto de fusión, la distancia entre las partículas va aumentando al ir moviéndose más deprisa, con lo que poco a poco la sustancia pasa al estado líquido, y toda la energía comunicada sirve para este proceso, razón por la que no se calienta el agua formada. Una vez fundido todo el hielo, se calienta el agua, que se va evaporando desde baja temperatura, pero lo hace de forma total al llegar al punto de ebullición.
 |
Gráfica de calentamiento
Observa la gráfica siguiente, que muestra la evolución temporal de la temperatura de una masa de sustancia que se está calentando.
a) ¿De qué sustancia se trata?
b) ¿Cuál es el estado físico inicial?
c) ¿Al cabo de cuánto tiempo comienza a fundir?
d) ¿Qué estado físico presenta a los 32 minutos?
Líquido, gas y vapor
 |
Si el estado físico de una sustancia a temperatura ambiente y presión atmosférica es el gaseoso, se usa el término gas (gas oxígeno). Pero si el estado en esas condiciones es el sólido o el líquido, se habla de vapor cuando pasa al estado gaseoso (vapor de agua, de sodio o de mercurio).
También hay una confusión terminológica enorme con respecto a este cambio de estado de líquido a gas: se utilizan casi indistintamente vaporización, evaporación y ebullición, cuando no significan lo mismo.
Vaporización: es el término general que indica el paso de líquido a vapor.
Evaporación: se produce a cualquier temperatura menor que la de ebullición (¡el agua de un charco se evapora a temperatura ambiente!).
Ebullición: es el paso de líquido a gas que se produce a la temperatura de ebullición.
 |
Sublimando iodo
Son pocas las sustancias que subliman. Por ejemplo, el naftaleno, que se utilizaba para hacer bolas de naftalina, usadas como antipolillas en los armarios de ropa, o el iodo, que se usa en disolución como desinfectante.
Observa en la imagen cómo sublima el iodo, dando un vapor de color muy intenso. Cuando el vapor se pone en contacto con una superficie fría, condensa dando lugar otra vez iodo sólido. Así que no se te ocurra hacerlo en un lugar cerrado, porque "decorarás" la habitación sin tener ninguna intención de hacerlo.
 |
Hielo y agua
Diseña un método experimental para comparar las densidades del agua líquida y del hielo para realizarlo después en tu casa.
 |
Hay ropa tendida
Siempre que es posible, la ropa se tiende al sol y bien extendida para que se seque antes. Según el modelo de partículas, la razón es que:
|
Si la temperatura de las partículas es mayor, se evaporan antes.
| |
|
Las partículas se mueven más deprisa y la superficie libre en contacto con el aire es mayor.
| |
|
Las partículas se hacen más pequeñas al calentarse la ropa, y escapan con más facilidad al aire.
| |
|
Al calentar, las partículas ocupan más espacio y escapan de la ropa.
|