1.1 Interpretación de las ecuaciones químicas
Experimentalmente se observa que en las reacciones
químicas desaparecen los reactivos y se forman los productos. Pero, ¿cómo se producen
las reacciones desde el punto de vista de las partículas que forman las
sustancias?
Diagramas de partículas
Fíjate en cómo se produce la reacción de síntesis del ácido clorhídrico. En la imagen puedes ver los modelos moleculares de H2, Cl2 y HCl (H blanco y Cl verde). En rojo se marcan los enlaces que se rompen y en verde los que se forman cuando se produce la reacción. También se representa la reacción con diagramas de partículas y mediante la ecuación química que la simboliza.
 |
 |
En la ecuación química se especifica que reacciona una molécula de H2 con una de Cl2 para formar dos de HCl. Esos tres números (1, 1 y 2) se llaman coeficientes estequiométricos, e indican la proporción de partículas de cada tipo que interviene en el proceso.
¡Pero si son los mismos átomos!
A escala de partículas, una reacción química consiste en una reorganización de átomos,
que dejan de estar unidos de una forma y pasan a estar unidos de otra.
Pero como se trata de los mismos átomos, la masa total de las distintas
sustancias es la misma: se conserva la masa.
Los coeficientes estequiométricos
Una molécula de Cl2 reacciona con una de H2 para formar dos de HCl. Pero esto es lo mismo que decir que dos de Cl2 reaccionan con dos de H2 para formar cuatro de HCl. Y que tres de Cl2 reaccionan con tres de H2 para formar seis de HCl. Fíjate en que en todos los casos la proporción de combinación es la misma: una partícula de Cl2 reacciona por cada una de H2 para formar dos de HCl.
En la ecuación química se escriben los coeficientes más sencillos (1, 1 y 2 en este caso). Si interviene una partícula no se escribe el uno, ya que la misma fórmula de la sustancia indica que hay una partícula.
En la simulación siguiente puedes ver la síntesis del agua. ¿Cuántas moléculas hay de reactivos (H2 y O2) y cuántas se forman de productos (H2O)?
La reacción se escribe 2 H2 + O2 → 2 H2O. Esto significa que reaccionan dos moléculas de hidrógeno por cada una de oxígeno para formar dos de agua. Que equivale a decir que reaccionan cuatro moléculas de hidrógeno con dos de oxígeno para formar cuatro de agua, que es lo que precisamente sucede en la simulación.
|
|
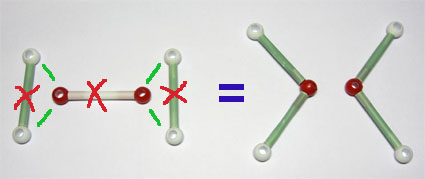 |
Fíjate también en la forma de producirse la reacción: se rompe un doble enlace O=O y dos enlaces sencillos H-H, formándose cuatro enlaces sencillos O-H.
El número de partículas
Ten en cuenta que, en general, en las reacciones químicas no se conserva el número de partículas. Sí lo hace en la reacción de formación del HCl (una molécula de H2 y una de Cl2 producen dos de HCl, desapareciendo dos moléculas y formándose otras dos), pero no en la formación del agua, en la que a partir de dos moléculas de hidrógeno y una de oxígeno se forman solamente dos moléculas de agua.