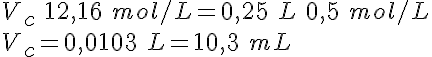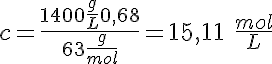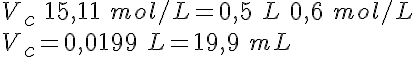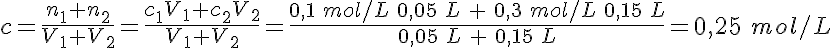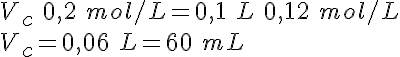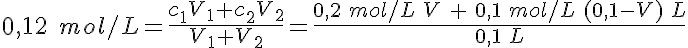6.3 Preparación de disoluciones
¿Qué debes hacer para preparar una disolución con la composición que te interese?
Vas a ver el procedimiento para preparar 250 mL de disolución de NaCl (sal común) de concentración 0.4 mol/L. En el vídeo tienes detallados los pasos fundamentales.
|
|
|
1. Prepara el material necesario: balanza, vidrio de reloj, espátula, vaso de precipitados, varilla, matraz aforado, frasco lavador con agua y sustancia a disolver (NaCl en este caso).
2. Haz los cálculos oportunos para saber la masa de NaCl que hay que pesar:
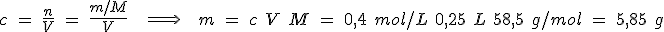
La balanza utilizada llega a medir 0.1 g, por lo que la pesada es de 5.9 g.
3. Coloca el vidrio de reloj en la balanza y táralo (la balanza marca 0, con lo que se descuenta el peso del vidrio).
4. Añade sal común con la espátula hasta que la balanza marque 5.9 g.
5. Pasa el sólido a un vaso de precipitados. Arrastra los últimos granos de sal con el frasco lavador, añadiendo un poco de agua sobre el vidrio.
6. Añade más agua al vaso de precipitados y agita hasta que se disuelva todo el sólido.
7. Pasa con cuidado la disolución al matraz aforado. Aprovechando el pico del frasco lavador, aclara dos o tres veces el vaso con el frasco lavador y añade el agua al matraz.
8. Completa con agua hasta el aforo, marca situada en el cuello del matraz que indica hasta dónde debe haber líquido para alcanzar la capacidad del matraz. Se suele hacer con un cuentagotas, o con el frasco lavador si se tiene una cierta costumbre. Esta técnica se llama enrasar.
9. Tapar y dar la vuelta al matraz varias veces para homogeneizar la disolución.
Por último, conviene etiquetar el matraz con la sustancia y su concentración o se almacena en un frasco de vidrio, también etiquetado.
|
En la disolución A.
| |
|
En la disolución B.
| |
|
Igual en los dos casos.
|
 |
Dilución de disoluciones
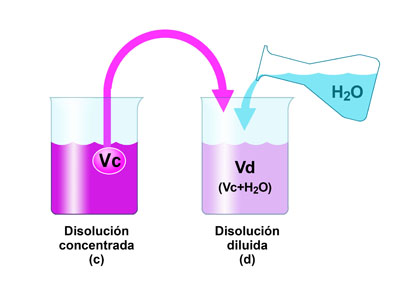
Si al cocinar un caldo te sale muy salado y lo quieres con sabor más suave ¿qué puedes hacer? Y si el color de una pintura es demasiado intenso y quieres rebajarlo ¿qué haces? Muy sencillo: añades agua, con lo que obtienes una disolución más diluida, con menor sabor o color.
En el laboratorio se dispone de un HCl concentrado, aproximadamente 12 mol/L. Sin embargo, como reactivo se suele utilizar en concentraciones de 1 mol/L o menores. ¿Qué debes hacer para preparar la disolución que necesitas?
Si te fijas en el dibujo, verás que se trata de tomar un volumen Vc de la disolución concentrada, de concentración Cc, y añadir un volumen de agua, Vagua (es decir, Cc>Cd). El volumen de la disolución diluida es la suma de los volúmenes mezclados (Vd=Vc+Vagua).
Pero la cantidad de sustancia de soluto en el volumen Vc de disolución concentrada es la misma que en el volumen Vd de disolución diluida, ya que se añade solamente agua; es decir, nc=nd. Escribiendo las cantidades de sustancia en función de la concentración y del volumen, se tiene la expresión final, que es la que se utiliza habitualmente:
Cc.Vc=Cd.Vd
Date cuenta de que debes saber tres de las cuatro magnitudes para poder calcular la que te falte.
En la imagen anterior puedes ver que si la disolución inicial está coloreada, la diluida tiene un color más claro. Fíjate ahora en las imágenes siguientes, que corresponden a un proceso de dilución real.
 |
 |
¿Y qué sucede cuando concentras una disolución? La forma más práctica es eliminar disolvente. Observa lo que le sucede a una disolución de sal común en agua cuando se evapora a sequedad: precipita el cloruro de sodio sólido que había disuelto.
Diluyendo ácido nítrico
El ácido nítrico concentrado (HNO3) es del 68% en masa y de densidad 1,40 g/mL. Indica el procedimiento para preparar 500 mL de HNO3 0,6 mol/L.
 |
Si mezclas disoluciones de la misma concentración, la concentración de la mezcla permanecerá constante, ya que la mezcla no la ha modificado.
Al diluir una disolución, un volumen determinado de disolución se mezcla con agua, con lo que la concentración disminuye. Pero ¿qué sucede cuando se mezclan dos disoluciones de la misma sustancia con concentraciones diferentes?
Fíjate en la imagen, con dos disoluciones de la misma sustancia pero de diferente concentración: el color es más intenso cuanto más concentrada está la disolución. Al mezclar ambas disoluciones, el color será intermedio: si mezclas disoluciones de concentraciones diferentes, la concentración cambiará, siendo intermedia con respecto a las de las disoluciones mezcladas.
En el caso particular de que los volúmenes mezclados sean iguales, la concentración será exactamente la media: la disolución resultante de mezclar 50 mL de HCl 0,1 mol/L con 50 mL de HCl 0,3 mol/L tiene una concentración de 0,2 mol/L.