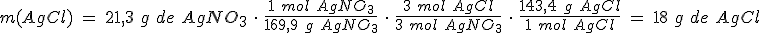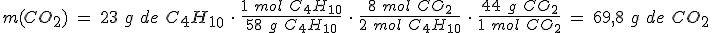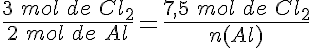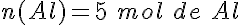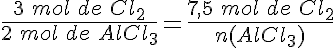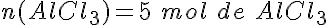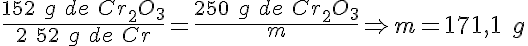3.2 Reactivos limitante y en exceso
 |
Una reacción química se produce en condiciones estequiométricas cuando las cantidades de reactivos (en moles) están en las proporciones idénticas a las de la ecuación química ajustada.
Es frecuente que se use un exceso de alguno de los reactivos para conseguir que reaccione la mayor cantidad del reactivo menos abundante.
El reactivo que se consume en su totalidad es el que va a limitar la cantidad de producto que se obtendrá y se denomina reactivo limitante. Los otros reactivos se llaman en exceso y no se consumen totalmente.
¿Cómo puedes saber cuál es el reactivo limitante? Por ejemplo, en la reacción del aluminio con el oxígeno para formar óxido de aluminio, mezclas para que reaccionen dos moles de aluminio con dos moles de oxígeno.
La ecuación ajustada es: 4 Al + 3 O2 → 2 Al2O3
y haciendo uso de la proporción estequiométrica entre el aluminio y el oxígeno:
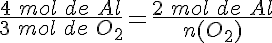
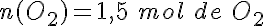
Por tanto, únicamente reaccionan 1,5 moles de O2 y quedan sin reaccionar 0,5 moles de oxígeno. El reactivo limitante es el aluminio, que se consume totalmente.
El reactivo limitante
Cuando en una reacción química intervengan cantidades de dos o más reactivos, antes de realizar los cálculos estequiométricos debes determinar cuál es el reactivo limitante, ya que será la referencia para todos los cálculos relacionados con la ecuación química ajustada.
Obtención de cloruro de plata
| |
Haces reaccionar 21,3 g de nitrato de plata con 33,5 g de cloruro de aluminio para preparar cloruro de plata y nitrato de aluminio. ¿Cuál es el reactivo limitante?
 |
Quemando butano
El butano (C4H10) se utiliza como combustible, tanto para cocinar como para tener calefacción y agua caliente. El C4H10 se combina con el oxígeno para formar dióxido de carbono y agua.
Si haces reaccionar 23 g de butano con 96 g de oxígeno, ¿qué masa de CO2 se desprenderá?
 |
Sintetizando cloruro de aluminio
Se hacen reaccionar 7,5 moles de cloro (Cl2) con 5,5 moles de aluminio (Al) para formar cloruro de aluminio (AlCl3). ¿Qué afirmaciones son ciertas?
El reactivo limitante es el cloro.
| |
El reactivo limitante es el aluminio.
| |
No reaccionan 0,5 moles de aluminio.
| |
Se forman 5 moles de cloruro de aluminio (AlCl3).
| |
-oxide-sample.jpg) |
Obtención de cromo
Para obtener metales de gran pureza a partir de sus óxidos, se hace reaccionar el óxido del metal con polvo de aluminio (termita).
Cuando haces reaccionar 250 g de trióxido de dicromo con 100 g de aluminio, se forma cromo y óxido de aluminio. ¿Cuál es la masa de cromo que obtienes?
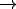 Al(NO3)3
+ 3AgCl
Al(NO3)3
+ 3AgCl