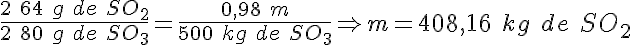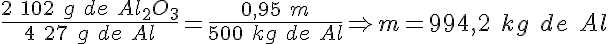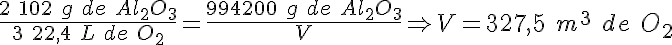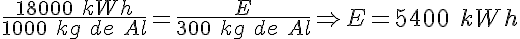4.3 Productos químicos de importancia industrial
Vas a ver el método de obtención de algunas de las sustancias de mayor producción industrial.
Ácido sulfúrico (H2SO4)
Es un ácido líquido, muy corrosivo, que reacciona violentamente con agua y con los compuestos del carbono desprendiendo mucho calor en el proceso.
Se trata del compuesto químico más producido en el mundo, por lo que su consumo suele utilizarse como medidor de la capacidad industrial de un país. Gran parte de su producción se emplea en la obtención de fertilizantes, aunque también es fundamental en la síntesis de otros ácidos y en la industria petroquímica.
Existen distintos procesos de producción del ácido sulfúrico, siendo el más común el de contacto, en el cual se emplea un catalizador para convertir el SO2 en SO3, del que se obtiene ácido sulfúrico por hidratación, en una instalación como la que se muestra en la imagen:
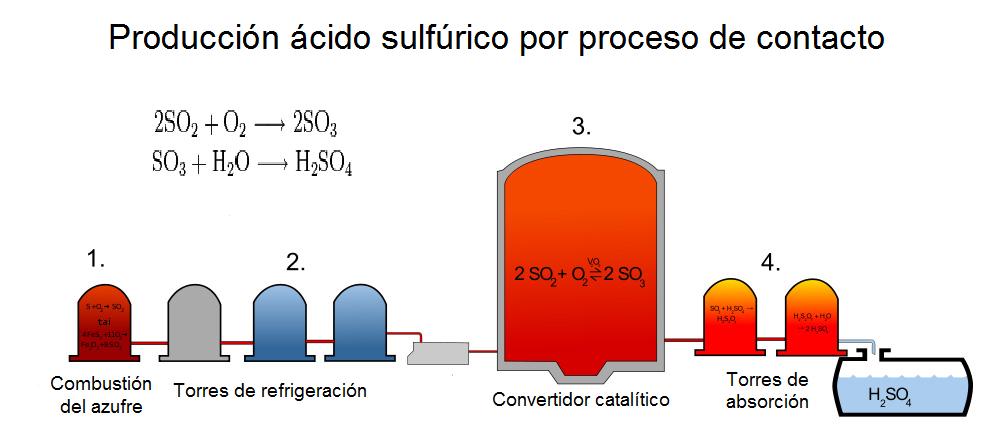 |
Amoniaco (NH3)
Es un gas incoloro de olor muy desagradable y penetrante; fácilmente soluble en agua pero muy volátil, en usos no industriales suele venderse disuelto en agua. Se produce a partir de la descomposición de la materia orgánica, pero también industrialmente.
Más del 75% del amoníaco producido en las plantas químicas se usa para fabricar abonos o para su aplicación directa como abono. El resto se utiliza en textiles, plásticos, explosivos, en la industria papelera y en productos de limpieza domésticos.
El amoniaco se obtiene mediante el proceso Haber-Bosch, consistente en la reacción directa entre el nitrógeno y el hidrógeno gaseosos. Esta es una reacción muy lenta (al tener una elevada energía de activación) por lo que se utiliza un catalizador (óxido de hierro). Aunque el grado de reacción se ve favorecido a bajas temperaturas, esta síntesis se realiza a altas temperaturas para favorecer la energía cinética de las moléculas y aumentar así la velocidad de reacción. A continuación se muestra el diagrama del proceso Haber-Bosch:
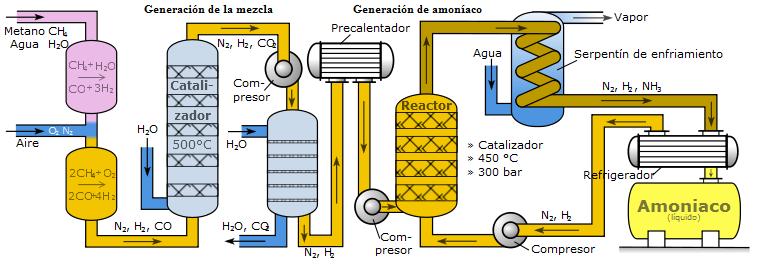 |
Ácido clorhídrico (HCl)
 |
Recibe este nombre cuando se encuentra disuelto en agua, siendo también conocido como salfumán. Puro se conoce como cloruro de hidrógeno, y a temperatura ambiente es un gas con una leve tonalidad amarillenta, más denso que el aire, corrosivo, no inflamable y de olor irritante. Al exponerse a la atmósfera forma un denso vapor blanco, también corrosivo. Aparece de forma natural entre los gases emitidos por volcanes.
Entre sus aplicaciones, hay que destacar su uso industrial para limpiar, tratar y galvanizar metales, curtir cueros, y en la refinación y manufactura de una amplia variedad de productos.
Puede obtenerse por adición de ácido sulfúrico a la sal común (NaCl), pero industrialmente se produce a partir de reacciones orgánicas de cloración de compuestos del carbono con cloro elemental. Otro método de producción a gran escala es por electrólisis de disoluciones de sal común, produciendo cloro, hidróxido de sodio e hidrógeno. El gas cloro así obtenido puede ser combinado con el gas hidrógeno, formando gas HCl químicamente puro.
En la síntesis del ácido sulfúrico
En el proceso de producción de ácido sulfúrico por el método de contacto, el rendimiento teórico de la reacción de conversión de dióxido de azufre en trióxido de azufre es del 98%.
¿Qué masa de dióxido de azufre será necesaria para producir 500 kg de SO3?
Metalurgia del hierro y del acero: los hornos altos
La obtención de hierro a partir de óxidos de hierro por reducción con carbón ha sido la base del desarrollo de muchas sociedades en el siglo XX. En España la siderurgia estuvo muy desarrollada, con grandes fábricas en Bilbao o Sagunto. Hoy en día se obtiene hierro para alearlo con carbón y otros metales, obteniendo acero, de mayor resistencia mecánica y que es inoxidable.
Fíjate en la imagen en la que se representa el proceso. Se carga el horno por la parte superior con mineral de hierro, caliza (fundente) y coque (carbón) que caen pulverizados por el horno y entran en contacto con el CO formado a alta temperatura, dando lugar a hierro fundido (arrabio) y escorias que se recogen por separado.
El proceso metalúrgico global es: Fe2O3 + 3 CO → 2 Fe + 3 CO2.
Proceso Bayer de electrolisis del aluminio
El método de producción no es precisamente moderno, ya que el método industrial utilizado es el proceso Bayer, que fue patentado por Karl Bayer en 1889.
En el proceso Bayer, primero se tritura la bauxita y luego se lava con una solución caliente de hidróxido de sodio (sosa cáustica), NaOH. La sosa disuelve los minerales de aluminio pero no los otros componentes de la bauxita, que permanecen sólidos. La reacción química que ocurre en esta etapa es:
A continuación se retiran de la solución los sólidos no disueltos, principalmente en un decantador seguido de unos filtros para eliminar los últimos restos. Los sólidos recogidos en el decantador, llamados "lodo rojo", se tratan para recuperar la sosa que no ha reaccionado y que se recicla al proceso. La solución de Al(OH)4-, ya libre de impurezas, se precipita de forma controlada para formar hidróxido de aluminio puro.
|
|
La solución de sosa libre de aluminio se concentra en unos evaporadores y se recicla al comienzo del proceso.
Por último, el hidróxido se calienta a unos 1050°C, en una operación llamada "calcinación", para convertirlo en alúmina (Al2O3), liberando vapor de agua al mismo tiempo:
2 Al(OH)3 → Al2O3 + 3 H2O
La alúmina obtenida se utiliza para producir aluminio mediante electrólisis según el proceso denominado de Hall-Heroult. Para ello se disuelve en un baño fundido de criolita (Na3AlF6) y se electroliza en una celda electrolítica usando electrodos de carbono, siendo la reacción producida:
2 Al2O3 → 4 Al (l) + 3 O2 (g)
Se realiza así pues la alúmina proveniente del proceso Bayer tiene un punto de fusión extremadamente alto y al mezclarlo con la criolita logra bajar el punto de fusión a alrededor de los 900 °C.
Por el elevado punto de fusión, el consumo energético que se utiliza para obtener aluminio es muy elevado y lo convierte en uno de los metales más caros de obtener, resultando mucho más rentable el reciclado del mismo.
Electrolisis del aluminio
Como has visto, en el proceso de electrolisis del óxido de aluminio (alúmina) se produce aluminio metálico, según la reacción:
La energía consumida en la producción de una tonelada de aluminio mediante este proceso es de 18000 kWh.
a) La cantidad de alúmina necesaria para producir 300 kg de aluminio metálico, supuesto un rendimiento del 95%.
b) Los litros de oxígeno, medidos en condiciones normales, que se desprenderán en el proceso.
c) La energía que se consumirá en la producción de los 300 kg de aluminio.