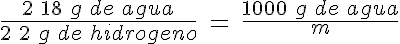3.1 Cálculos en masa
Este es el aspecto realmente práctico. Por ejemplo, para saber en una industria metalúrgica cuánto hierro se obtiene por kilogramo de óxido de hierro que reacciona. Ese hierro se utilizará después para obtener acero, con el que se fabrican objetos de todo tipo como tubos, depósitos para líquidos, cuberterías, etc.
 |
 |
¿Cuánto CO2 se produce al quemar carbón?
Para ver el método de trabajo, vas a utilizar la ecuación de la reacción de combustión de carbono, que es C (s) + O2 (g) → CO2 (g), y que a escala de partículas se escribe como:
C + O2 → CO2
La ecuación es muy sencilla y ya está ajustada: reacciona una molécula de oxígeno por cada átomo de carbono, y se forma una molécula de dióxido de carbono, que es lo mismo que decir que un mol de C reacciona con un mol de O2 para formar un mol de CO2.
Con los datos de las masas atómicas relativas, puedes calcular las masas molares de cada una de las tres sustancias, que sumando las masas atómicas relativas son, respectivamente, de 12, 32 y 44 g/mol.
Por tanto, puedes decir que 12 g de C reaccionan con 32 g de O2 para formar 44 g de CO2.
Para calcular la masa de CO2 formada, puedes aplicar la ley de las proporciones constantes o bien utilizar un factor de conversión:
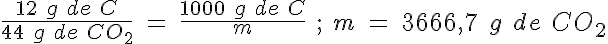
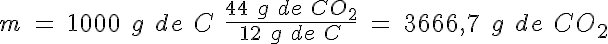
Cálculos estequiométricos en masa
¿Cómo puedes realizar estos cálculos utilizando las ecuaciones que representan a las reacciones que se producen? Para determinar la masa de una sustancia que interviene en una reacción química debes seguir cuatro pasos:
1) Escribe y ajusta la ecuación de la reacción.
2) A partir de la ecuación ajustada, sabes la proporción de combinación en cantidades de sustancia entre los reactivos o productos que te interese en cada caso.
3) Determina la masa molar de las sustancias de las que te dan datos o te piden resultados.
4) Aplica la ley de las proporciones constantes, directamente o con factores de conversión, para calcular la masa de sustancia que tengas que determinar.
El combustible del futuro
El hidrógeno probablemente sea el combustible del futuro. Partiendo de un kg de agua, ¿cuánto hidrógeno se puede obtener?
Obteniendo hierro
Determina la masa de hierro que se obtiene en una industria metalúrgica por cada kilogramo de óxido de hierro (Fe2O3) que se descompone en hierro (Fe) y oxígeno (O2).
Descomponiendo clorato de potasio
Sabiendo que cuando se descomponen el clorato de potasio (KClO3) se produce cloruro de potasio (KCl) y oxígeno (O2), determina la cantidad de clorato de potasio necesaria para obtener 500 g de oxígeno.