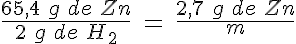3.2 Resolviendo problemas
En las situaciones reales te puedes encontrar con los casos siguientes, que pueden darse a la vez:
Reactivos en disolución
Como sabes su composición en gramos o moles por litro y te darán el volumen de disolución que añades, determinarás la masa o la cantidad de sustancia de reactivo que hay disponible.
Reactivos impuros
Sabiendo el porcentaje de pureza determinarás la masa de reactivo de que realmente dispones.
Reactivos en exceso
Se debe a que se consume totalmente otro, por lo que tienes que determinar previamente cuál es el reactivo limitante y cuál está en exceso.
A continuación tienes un problema resuelto en el que aparecen las tres situaciones a la vez: Zn impuro y HCl en disolución, de forma que hay exceso de uno de los dos reactivos.
Neutralizando la acidez de estómago
Cuando se tiene acidez de estómago, producida por un exceso de secreción de HCl por las glándulas gástricas, se toma bicarbonato para contrarrestar su efecto (neutralización). Si hay un exceso de producción de 2 g de ácido, calcula la masa de bicarbonato que se debe tomar para neutralizarlo según la reacción:
NaHCO3 (aq) + HCl (aq) → NaCl (aq) + CO2 (g) + H2O (l)
Producción de cloro
El cloro es un gas que se utiliza como materia prima en la obtención de insecticidas, lejía, plásticos, etc. Se obtiene industrialmente por electrolisis de acuerdo con la reacción
NaCl (aq) + H2O (l) → Cl2 (g) + H2 (g) + NaOH (aq)
Calcula la masa de cloro que se obtiene por cada kilogramo de sal común del 92 % que reacciona.