3.1 Ley de Boyle
 |
Relación presión - volumen a temperatura constante
La propuso Boyle en 1662, e indica que cuando se aumenta la presión sobre un gas a temperatura constante y sin cambiar la cantidad de gas, el volumen que ocupa el gas disminuye de forma inversamente proporcional a la presión ejercida (que la presión sea doble significa que el volumen pasa a ser la mitad).
Se explicita como PV = cte, o bien PiVi = PfVf, donde i se refiere a la situación inicial del gas y f a la final.
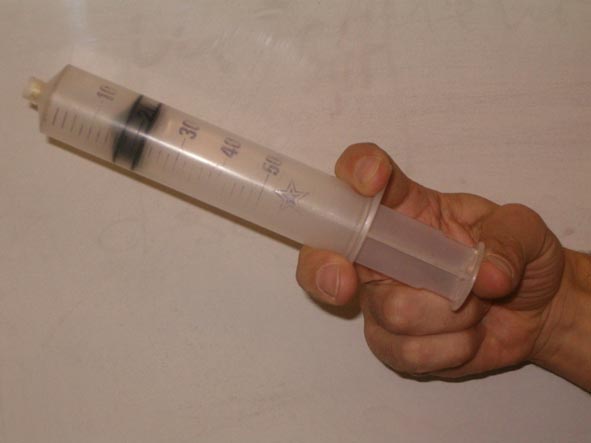
En la imagen hay una jeringa que tiene la punta cerrada con pegamento. Al empujar el émbolo, cada vez resulta más difícil comprimir, y en el momento en que se suelta, vuelve a la situación inicial. Analizando el proceso, al aumentar la presión se produce una disminución de volumen, de acuerdo con la ley de Boyle.
La ley de Boyle
En el simulador simplemente tienes que arrastrar el émbolo con el ratón -pulsar sin soltar- hasta donde quieras: en el momento en que lo sueltes, se anotarán en la tabla los valores de volumen y presión.
Si lo haces al menos cinco veces, dispondrás de cinco pares de datos. Si pulsas Graph verás la forma gráfica de la representación. Si indicas que se represente el volumen frente a 1/P, la gráfica es una recta. En resumen, se cumple que PV = constante.
Puedes probar con los cuatro gases, y verás que los resultados son similares.
|
1 atm
| |
|
0.5 atm
| |
|
2 atm
|