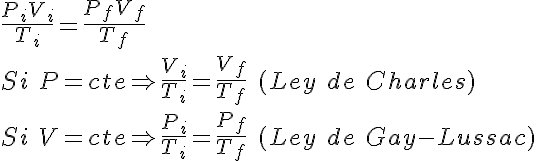3.3 Síntesis de las leyes
Las tres leyes referidas a un único gas (Boyle, Charles y Gay-Lussac) se pueden resumir en una única ecuación matemática:
PV/T=cte (que depende de la cantidad de gas)
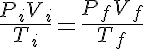
Fíjate
en que si mantienes constante la temperatura T, la ecuación general se reduce a
PV=cte, ya que al ser Ti = Tf puedes simplificar la igualdad. Es decir, se obtiene la ley de Boyle. Evidentemente, la constante de esta ley de Boyle es distinta de la constante de la ecuación general.
De forma similar, manteniendo constante la presión o el volumen, obtendrás las leyes de Charles y de Gay-Lussac.
Fíjate en que las constantes de las leyes dependen de la cantidad de gas que hay en el recipiente y su valor es diferente en cada ley.
Deducción de las leyes de los gases
Deduce las leyes de Charles y de Gay-Lussac utilizando la ecuación general de los gases.
Mezclas de gases
 |
Cuando hay varios gases en un recipiente, se encuentran formando una mezcla homogénea, y no es posible diferenciar unos de otros, pero se comportan como si cada uno de ellos estuviera solo en el recipiente.
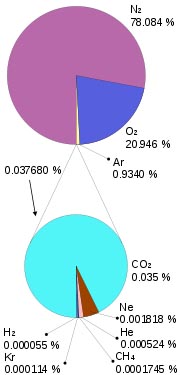
Es el caso del aire, que tiene un 78% en volumen de nitrógeno y casi un 21% de oxígeno, junto a porcentajes muy pequeños de dióxido de carbono, vapor de agua, gases nobles, etc.
En las mezclas de gases, las partículas más grandes se mueven más despacio y las pequeñas más deprisa, pero su energía cinética es la misma: lo importante es el número de partículas, independientemente de cuáles sean.
Por tanto, la presión de la mezcla depende del número total de partículas, que es la suma de las partículas que hay de cada tipo en una mezcla, como se indica en la ley de Dalton.
En 1803, Dalton enunció una ley referida a las mezclas de gases: cuando hay varios gases en un mismo recipiente, la presión total producida por la mezcla es la suma de las presiones que cada uno de los gases generaría si estuviera solo en el recipiente. Es decir, la presión total es la suma de las presiones parciales.
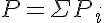
|
|
El mecanismo de la respiración
Observa cómo respiramos las personas. Los pulmones están dentro de la caja torácica y cuando el músculo respiratorio (diafragma) baja, aumenta el espacio que pueden ocupar, por lo que la presión interior disminuye. Para igualarla con la exterior, entra aire. Al relajarse el diafragma, el efecto es el contrario, y se expulsa aire de los pulmones.
Date cuenta de que no se explica con ninguna de las leyes anteriores, porque en ellas no cambiaba la cantidad de gas en el sistema, que estaba cerrado, mientras que ahora está abierto, entrando o saliendo gas según resulte necesario.