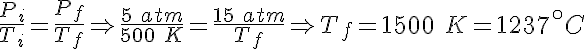3.2 Leyes de Charles y de Gay-Lussac
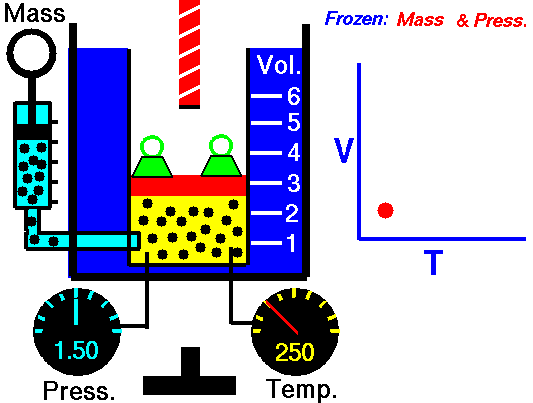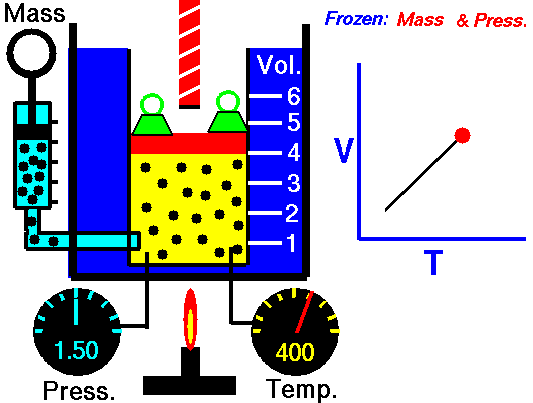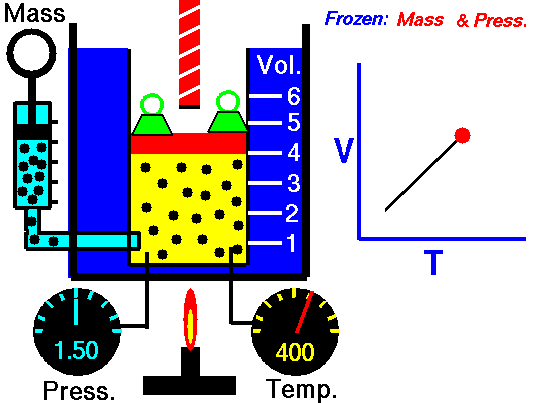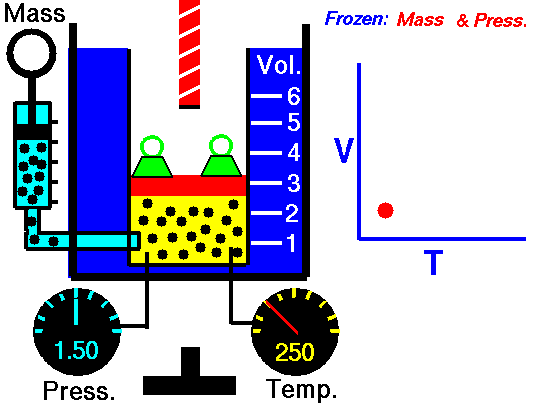 |
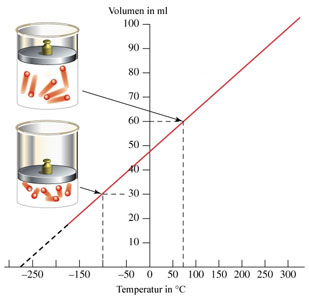
En 1787, Charles estudió experimentalmente la relación entre la temperatura a la que se encuentra un gas y el volumen que ocupa, observando que si una masa fija de gas se calienta a presión constante, su volumen aumenta proporcionalmente a la temperatura en Kelvin.
Si observas la imagen, verás la diferencia entre el aire a temperatura ambiente (izquierda) y el aire caliente (derecha): en el segundo caso, el volumen ocupado es mayor. Si se deja enfriar hasta la temperatura inicial, el globo también vuelve a tener el tamaño inicial.
Esta ley se suele explicitar como V/T = cte o bien Vi/Ti = Vf/Tf.
De la misma forma, al enfriar el gas su volumen disminuye. Bajando la temperatura hasta donde resulta posible y extrapolando la recta resultante, se observa que el gas ocuparía un volumen cero a -273.15 ºC, que es 0 K, la menor temperatura que se puede alcanzar.
 |
 |
En 1802, Gay-Lussac estudió experimentalmente el comportamiento de los gases cuando se calentaba una masa fija de gas en un recipiente de volumen constante. Observó que al aumentar la temperatura, la presión también lo hacía de forma proporcional.
|
|
Esta ley se suele explicitar como P/T= cte o bien Pi/Ti = Pf/Tf
De la misma forma que antes, extrapolando la recta resultante en la zona de bajas temperaturas, se obtiene que la presión se anularía a -273ºC (0 K).
Observa en la animación los valores de la presión y la temperatura y pulsa la tecla para calentar. Si el recipiente tiene un volumen fijo, las partículas del gas aumentan su energía cinética, por lo que chocan más veces por unidad de tiempo con las paredes del recipiente, al moverse más deprisa, y lo hacen con más intensidad. Por tanto, la presión aumenta. Además, al llegar a una temperatura doble, también se duplica la presión, como se deduce de la ley de Gay-Lussac.
Verdadero Falso
Verdadero Falso
Verdadero Falso