2.6 Propiedades de las disoluciones
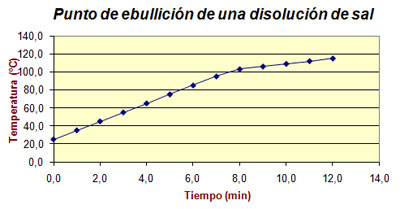 |
Las propiedades de las disoluciones son diferentes de las del disolvente. Precisamente esa diferencia se utiliza como criterio de pureza. Por ejemplo, el punto de ebullición del agua pura es de 100 ºC y la temperatura no cambia mientras hay agua hirviendo. Sin embargo, en una disolución de sal en agua el punto de ebullición es mayor y además la temperatura va aumentando mientras continúa la ebullición, como puedes ver en la imagen.
La magnitud de la diferencia depende de la composición de la disolución: es más grande cuanto mayor es la proporción de soluto y, por tanto, cuanto más concentrada está la disolución.
El punto de congelación del agua dulce y del agua salada
Vas a utilizar el congelador del frigorífico de tu casa para hacer un experimento. Añade agua hasta la mitad a un vaso, y agua lo más salada posible a otro vaso hasta el mismo nivel. Colócalos en el congelador y observa el proceso de congelación cada media hora. Cuando los dos líquidos estén congelados, sácalos y déjalos al aire, observando la textura de los dos sólidos y cómo se funden.
a) Anota tus observaciones.
b) Compara los puntos de fusión del agua y de la disolución de sal.
c) ¿Conoces alguna aplicación práctica de este hecho experimental relacionada con el tráfico invernal?
 |
La densidad de las disoluciones
Las disoluciones de sales en agua (la sal común o cloruro de sodio es una sal, pero hay muchas otras, como el sulfato de cobre, el nitrato de potasio, etc) tienen una densidad mayor que la del agua. Su valor puede llegar a ser tan alto como en el Mar Muerto (Jordania), de 1,17 g/mL, mientras que la densidad del cuerpo humano es de 1,05 g/cm3.
Si te fijas en la fotografía, hay una persona leyendo el periódico mientras flota precisamente en el Mar Muerto. Ahora ya sabes la razón.
¡Por cierto! No hace falta que vayas tan lejos para experimentar esa sensación: no tienes mas que visitar el Salinar de Naval, cerca de Barbastro (Huesca), en el que hay un centro turístico con varias pozas de agua muy salada en las que se flota sin dificultad.
Ósmosis
Cuando se ponen en contacto dos disoluciones de diferente concentración separadas por una membrana semipermeable, las partículas de agua, que son las más pequeñas, pasan a través de los poros de la membrana desde la disolución más diluida a la más concentrada, hasta que las dos disoluciones tienen la misma concentración. Este fenómeno se llama ósmosis, y se da en procesos como la absorción de agua por las plantas. También tiene lugar en las células, como puedes ver en la animación.
|
|
 |