Física y química 4º de ESO Tema 1. Estructura de la materia
 |
Partiendo del modelo de partículas de la materia y del análisis de una gran cantidad de hechos experimentales, Dalton propuso en 1803 su teoría atómica, que recoge el concepto de átomo, ya planteado por los griegos en la antigüedad sin base científica, por contraposición a los cuatro constituyentes fundamentales de la materia de la tradición alquímica medieval: aire, agua, tierra y fuego.
Para él, la unidad más pequeña de materia es el átomo, partícula indivisible característica de cada sustancia simple, formada por uno o varios átomos iguales.
Actualmente se conocen más de 100 tipos de átomos diferentes. Cada uno de esos tipos de átomo recibe el nombre de elemento químico.
Fíjate en la imagen en la representación que Dalton hizo de los átomos, con una base circular, del tipo que ya has utilizado. En algunos casos, dentro del círculo hay una letra, inicial del nombre en inglés.
La representación actual es mediante letras, una o dos, de origen latino en algunos casos y en honor a científicos importantes o lugares en otros.
Principios de la teoría atómica de Dalton
1. La materia está formada por átomos.
2. Los átomos son indivisibles.
3. Todos los átomos de una sustancia simple son iguales entre sí.
4. En las sustancias compuestas hay átomos diferentes.
 |
Cuando en un recipiente hay una sola sustancia, se trata de una sustancia pura, y si hay más de una se trata de una mezcla de sustancias.
Si se pueden diferenciar los componentes de la mezcla, se trata de una mezcla heterogénea, y en caso contrario, de una mezcla homogénea (disolución).
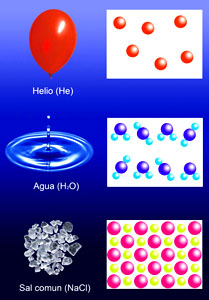
Pero ¿cómo son las partículas que forman una sustancia pura? Por ejemplo, las partículas de agua son distintas de las de helio y de las de sal común, ya que las tres sustancias tienen propiedades muy diferentes.
¿En qué se basa esa diferencia? La respuesta es que están formadas por una combinación diferente de átomos: en el agua hay moléculas formadas por dos átomos de hidrógeno unidos a uno de oxígeno, y su estado a temperatura ambiente es el líquido. En el helio hay átomos libres, y su estado físico es el gaseoso, mientras que la sal común no forma moléculas, sino que da lugar una estructura con "átomos" de sodio y de cloro que no tiene más límite que el tamaño del trozo de sal: es lo que se conoce como una estructura gigante, siendo sólido el estado físico.
El tipo de partícula a que da lugar la unión de átomos depende precisamente de cuáles son esos átomos y de qué forma se unen, es decir, del enlace químico producido entre ellos.
Sustancias simples y compuestas
Punto de vista experimental: si se pueden descomponer en otras más sencillas, son compuestas, y simples en caso contrario.
Escala de partículas: si los átomos que las forman son iguales, se trata de una sustancia simple, y si hay átomos distintos, compuesta.
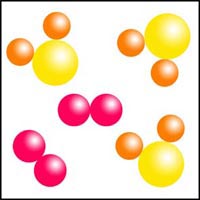
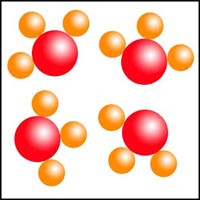
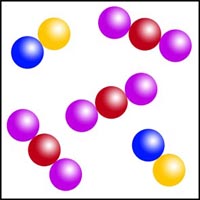
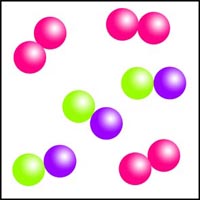
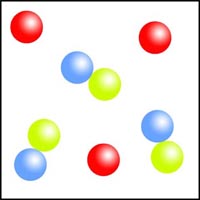
Clasificación de diagramas de partículas
Observa los diagramas de partículas siguientes. Clasifícalos en sustancias puras o mezclas, indicando en cada caso si se trata de sustancias simples o de sustancias compuestas.
 |
 |
 |
| (a) | (b) | (c) |
 |
 |
 |
| (d) | (e) | (f) |