3. La medida de la masa de los átomos
En la tabla periódica siguiente tienes detalladas las propiedades más importantes de cada elemento. En este momento solamente te vas a fijar en la masa atómica.
Masa atómica relativa
La masa que aparece en la tabla periódica corresponde al promedio ponderado de las masas de los isótopos del elemento. De esta forma, el dato de masa atómica relativa del cloro se calcula teniendo en cuenta que el isótopo 35 tiene una abundancia del 77,50 % y el 37 del 22,50 %:
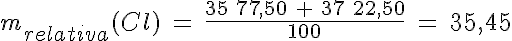
Sin embargo, no hay ningún átomo de cloro que tenga esa masa (ni tampoco en otros elementos, salvo que el elemento no tenga isótopos, caso muy poco habitual, y todos los átomos tengan la misma masa).
Su valor indica cuántas veces tiene más masa un átomo de un elemento químico que la masa que se toma como referencia. Inicialmente se tomó como patrón la masa del átomo de hidrógeno, pero actualmente es la doceava parte de la masa atómica del isótopo 12 del carbono. La diferencia es muy pequeña: 1,0000 o 1,008 para la masa atómica relativa del H.
El orden creciente de número atómico por el que se ordenan los elementos en la tabla se reproduce en el orden de masas atómicas, salvo en tres excepciones: Ar-K, Co-Ni y Te-I, pares en los que el segundo elemento, que va detrás en la tabla, tiene menos masa que el primero.
La unidad de masa atómica
Inicialmente se tomó como patrón de referencia de masas a escala atómica (unidad de masa atómica, uma ó u) la masa del átomo de hidrógeno, pero actualmente el patrón es la doceava parte de la masa atómica del isótopo 12 del carbono.
La masa real de la uma es 1,66 10-24 g.
La masa de los iones
La masa de los átomos y la de los iones que forman se consideran iguales, ya que la diferencia es la masa de los electrones ganados o perdidos, despreciable en comparación con la masa del átomo neutro. Es decir, si la masa relativa del Na es 23, la del ión Na+ también es 23.
Masa de los átomos y de los iones
Determina las masas del isótopo 23 del sodio y del ión sodio Na+ que produce. Utiliza las masas de las partículas fundamentales en cada caso. ¿Qué diferencia de masas hay?