4. El enlace entre los átomos
 |
¿Por qué se unen los átomos?
Los únicos átomos que existen libres en la naturaleza son los de los gases nobles, que se utilizan en iluminación decorativa. Como tiene su última capa electrónica completa, su situación es muy estable y no cambia.
Sin embargo, el resto de átomos tiende a completar su última capa (regla del octeto), porque esa situación es la más estable.
¿Cómo quedan unidos los átomos?
Las fuerzas que mantienen unidos los átomos son de naturaleza electrostática.
Si dos átomos están separados, no interaccionan, pero si se acercan aparecen fuerzas electrostáticas entre los núcleos y los electrones de los dos átomos (atractivas entre el núcleo de un átomo y los electrones del otro, y repulsivas entre los núcleos de los dos átomos por un lado y entre los electrones de ambos átomos por otro).
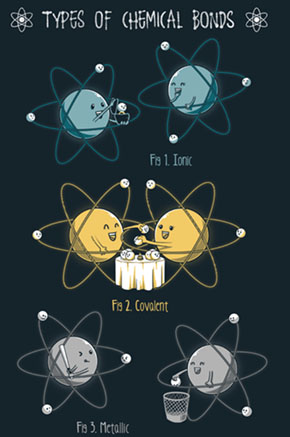
Hay tres mecanismos fundamentales de unión de átomos, tres tipos de enlace.
Enlace iónico
Si los átomos tienen pocos electrones en la capa más externa (entre 1 y 4), los pierden con facilidad, formando cationes (iones positivos). Es lo que les sucede a los elementos metálicos.
Si los átomos necesitan pocos electrones para completar su capa más externa (también entre 1 y 4), los ganan, dando lugar a aniones (iones negativos). Este comportamiento lo tienen los elementos no metálicos.
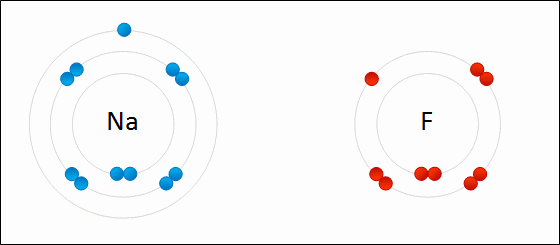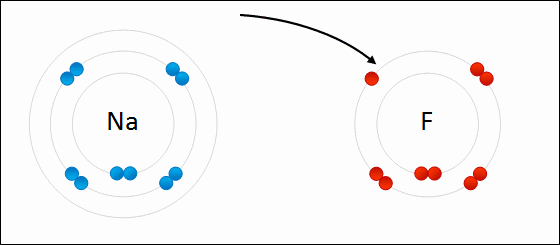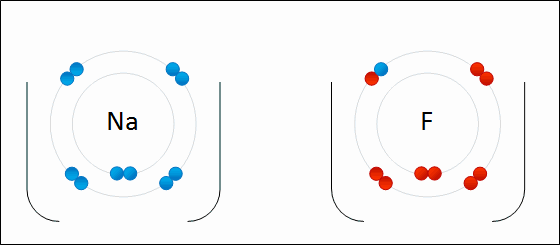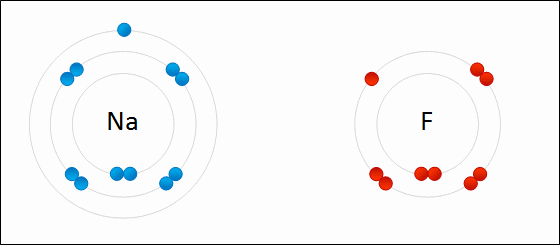 |
En general, los átomos se ionizan perdiendo o ganando electrones para tener completa la última capa electrónica, de forma que los electrones que pierde un átomo para formar un catión los gana otro dando lugar a un anión.
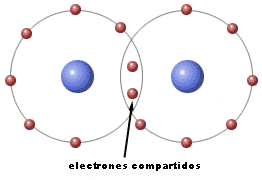 |
Enlace covalente
Pero si se ponen en contacto sustancias cuyos átomos necesitan ganar electrones para completar sus capas más externas, no puede haber transferencia de electrones, porque ningún átomo puede perderlos. La solución consiste en compartirlos, de manera que inicialmente cada uno de los dos átomos tenía un electrón propio, y al unirse los dos electrones pertenecen a la vez a los dos átomos, los comparten. Se dice que el enlace es covalente, por compartición de electrones.
Enlace metálico
En este caso a todos los átomos les sobran electrones. Se trata del caso más complejo y solamente verás un modelo de enlace metálico muy sencillo aunque incompleto.