2.3 Otras propiedades periódicas
 |
Tamaño de los átomos
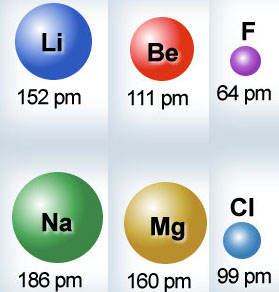
Es muy sencillo justificar la diferencia de tamaño de los átomos de los elementos de un grupo de la tabla. En la imagen puedes ver el radio comparado de tres pares de átomos del mismo grupo, supuesto que son esferas perfectas. Los datos se dan en picometros (pm), que equivalen a 10-12 metros.
Si observas los datos, es mayor en todos los casos el tamaño del átomo de los elementos que están más abajo en el grupo de la tabla periódica (alcalinos, alcalinotérreos y halógenos).
¿Cómo puedes justificar este hecho experimental? Solamente debes tener en cuenta las estructuras electrónicas respectivas de los elementos:
Li: 2, 1
Na: 2, 8, 1
Es decir, los dos átomos tienen un único electrón en la capa más externa. Pero como en el Na hay una capa más que en el Li (tres y dos), el Na es mayor.
El mismo razonamiento puedes aplicar en los otros dos casos. Pero no intentes justificar por qué el radio disminuye de Li a Be y a F: la razón es mucho más compleja y queda para Bachillerato.
Carácter metálico
Los metales son los elementos que tiene tendencia a perder electrones, mientras que los no metales tienen tendencia a ganarlos.
Serán metales aquellos elementos con pocos electrones en la capa más externa, y que pueden perderlos con facilidad, como sucede en los alcalinos y los alcalinotérreos, que pierden uno o dos electrones para quedarse con la capa más externa completa. Están colocados hacia la izquierda en la tabla periódica.
Por el contrario, los no metales ganan electrones para completar su capa electrónica más externa. Están situados hacia la derecha de la tabla.
Los gases nobles no tienen carácter metálico ni no metálico.
En la imagen los metales aparecen en azul, los no metales en naranja y los gases nobles en rojo. Los elementos en color verde oscuro son los semimetales, que tienen características intermedias entre metales y no metales.
El metal del futuro
 |
El uso del silicio fue durante el siglo XX fue fundamental para la revolución de la electrónica y la informática. En el siglo XXI el elemento que ha tomado la delantera en la revolución tecnológica es el litio.
¿Por qué? El desarrollo de objetos de comunicación (ordenadores, tablets, ebooks, teléfonos móviles, etc) cada vez más pequeños y que necesitan de más autonomía de funcionamiento está impulsando la investigación para disponer de baterías de menor peso, más potencia y mayor duración. Y el litio es el metal que se utiliza para construirlas.
Utiliza un buscador para responder las preguntas siguientes:
a) ¿Para qué se utiliza también el litio?
b) ¿Cómo ha evolucionado su producción en los últimos años? ¿Qué previsiones hay para el futuro?
c) ¿En qué países se sitúan los yacimientos de litio? ¿Tiene importancia política que en un país haya yacimientos de este metal?