3.1 Una escala de masas relativas
¿Cómo se determina la escala de masas atómicas relativas?
|
|
Vas a trabajar con la simulación siguiente. Observa que hay seis erlenmeyers iguales (misma masa y volumen). Uno de ellos está vacío, y los otros cinco tienen gases diferentes (cloro, oxígeno, hidrógeno, vapor de agua y iodo), de forma que su temperatura y la presión que producen es la misma.
Según el modelo de partículas de la materia que ya conoces, la presión está originada por el movimiento desordenado de las partículas del gas al chocar con las paredes del recipiente que las contiene. Como la temperatura es la misma, la energía del choque es la misma en todos los casos. Luego si la presión tiene el mismo valor, se debe a que en todos los recipientes hay el mismo número de partículas. Este razonamiento se conoce como hipótesis de Avogadro.
La masa de las moléculas de un gas
Determina la masa de gas que hay en cada uno de los recipientes. ¿A qué crees que se debe la diferencia?
Una escala de masas relativas
De acuerdo con las medidas anteriores, la masa de gas en el recipiente que contiene cloro (m) es el número de partículas que hay de cloro (N) por la masa de cada una de ellas (M). Lo mismo sucede en el resto de los gases, considerando que N es el mismo en todos los casos pero M es diferente.
| m(cloro) = N(cloro).M(cloro) = 0,887 g |
| m(oxígeno) = N(oxígeno).M(oxígeno) = 0,400 g |
| m(hidrógeno) = N(hidrógeno).M(hidrógeno) = 0,025 g |
| m(vapor de agua) = N(vapor de agua).M(vapor de agua) = 0,215 g |
| m(iodo) = N(iodo).M(iodo) = 3,169 g |
Como en el erlenmeyer que contiene hidrógeno hay la menor masa de gas, la partícula de hidrógeno es la de menor masa, y, por tanto, se toma como referencia: vas a determinar cuántas veces tiene más masa cada una de las otras cuatro partículas que la de hidrógeno.
Para ello, divides la igualdad de cada gas por la del hidrógeno, de la forma siguiente para el cloro:
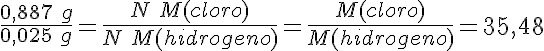
El dato de masa atómica relativa del cloro que aparece en la tabla periódica es muy aproximadamente 35,48, aunque ningún átomo de cloro tiene esa masa.
Debes tener en cuenta que las moléculas de hidrógeno, cloro, oxígeno y iodo son biatómicas, por lo que si hay N moléculas también hay 2N átomos, pero la relación anterior no varía.