3.2 Medida de la masa de las partículas
La unidad de masa atómica
La masa real de un átomo de un elemento se mide en unidades de masa atómica (cuyo símbolo se escribe u o uma) que es la masa real tomada como referencia a escala atómica.
De esta forma, se puede decir que la masa atómica relativa del cobre es 63,54, y que su masa real es de 63,54 u.
La masa real de las partículas
Para saber la masa real de un átomo, molécula o ión solamente necesitas saber qué masa real tiene la unidad de masa atómica, cuyo valor es de 1,66 10-24 g.
Es decir, en el caso anterior:
¿Cuántos átomos hay en un gramo de cobre? Acabas de ver que un átomo de cobre tiene una masa de 1,055 10-22 g. Por tanto, no tienes mas que plantear la proporción siguiente:
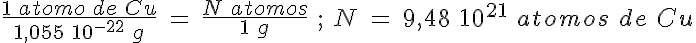
Esto supone que para tener un gramo de cobre hacen falta 9,48 1021 átomos, que son nada menos que 9480 trillones de átomos. ¡La masa de los átomos es realmente muy pequeña!
El número de Avogadro
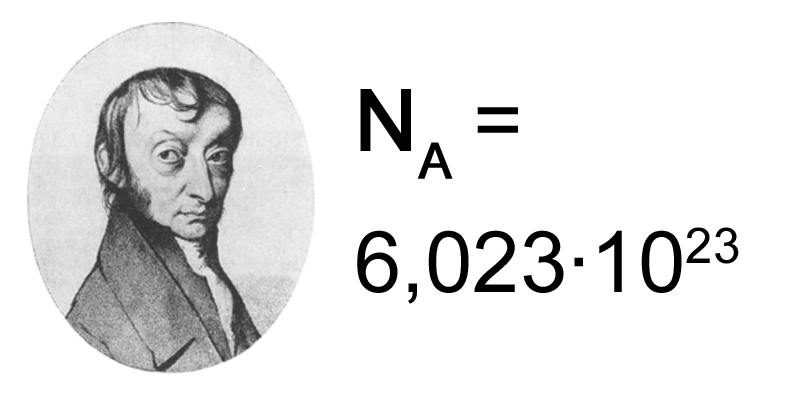 |
Si en lugar de calcular el número de átomos que hay en un gramo de cobre quieres determinar el número que hay en 63,54 gramos de cobre (es decir, en una masa en gramos numéricamente igual a su masa atómica relativa), no tienes mas que cambiar el número 1 por 63,54 en la proporción resuelta antes. El resultado obtenido es 6,023 1023.
Y si repites el cálculo con cualquier otro átomo, molécula o ión, siempre sale ese número de partículas 6,023 1023. Es decir, en una masa medida en gramos de cualquier sustancia igual a su masa atómica, molecular o iónica relativa hay 6,023 1023 partículas (átomos, moléculas o iones). Ese número tiene una importancia extraordinaria en Química y recibe el nombre de número de Avogadro.