4.2 Enlace covalente
En este caso, los dos átomos que se van a enlazar necesitan electrones, por lo que los comparten para completar sus capas electrónicas más externas respectivas. Se llama valencia al número de enlaces formados y el enlace recibe el nombre de covalente.
La forma más sencilla de justificar la formación de sustancias con enlaces covalente es utilizar las estructuras electrónicas de Lewis. Como cada uno de los dos átomos unidos aporta un electrón al par compartido, se suele trabajar directamente con pares de electrones.
¿Cómo se representan las estructuras de Lewis?
-
Se determina el número de electrones de la capa más externa de todos los átomos de la sustancia (1 en H, 4 en C, 5 en N, 6 en O, 7 en Cl, etc) y se establece el número total de pares de electrones a distribuir.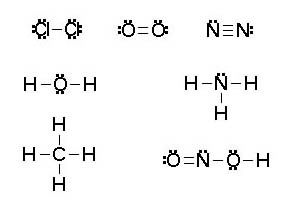
- Se colocan los átomos unidos entre sí por un par de electrones. Las distribuciones espaciales de átomos suelen ser simétricas.
- El número de pares resultante se reparte entre todos los átomos de manera que se cumpla la regla del octeto.
- Cada par de electrones se representa por dos puntos o una raya.
-
Si no hay suficiente número de pares de electrones, se utilizan enlaces dobles o triples para alcanzar el octeto.
La regla del octeto no siempre se cumple
 |
La regla del octeto tiene excepciones: hay moléculas en las que el átomo central está rodeado por 2, 3, 5 o 6 pares de electrones, por lo que no se cumple la regla del octeto.
Por ejemplo, el azufre está rodeado por seis pares de electrones en el H2SO4, el nitrógeno por cinco en el ácido nítrico (HNO3), pero el boro solamente por tres pares en el BF3, y el berilio por dos en el BeCl2. ¡Y en todos los casos se trata de moléculas estables!
Moléculas y estructuras gigantes covalentes
Los enlaces covalentes dan lugar habitualmente a moléculas. Las sustancias moleculares constituyen un porcentaje superior al 95% entre todas las sustancias conocidas hoy en día.
Pero en unos pocos casos se forman sustancias cuyas propiedades no se parecen nada a las moleculares. Los casos más conocidos son la sílice (SiO2) y el diamante (C). En esas sustancias no hay moléculas, sino que se forma una estructura gigante de átomos unidos mediante enlace covalente.

|
 |
Modelos moleculares y fórmulas
Observa los modelos moleculares siguientes. Escribe la fórmula de la sustancia de que se trata en cada caso y representa su estructura electrónica de Lewis.
 |
 |
 |
| (a) |
(b) | (c) |
Construcción de modelos moleculares
Los modelos que vas utilizar tienen la siguiente clave de colores para los átomos:
| C negro |

|
N azul |

|
| H blanco |
S amarillo |
||
| O rojo |
Cl verde |
Para unir los átomos se utilizan varillas verdes, que indican enlace
sencillo, y blancas, que significa un enlace doble entre los átomos unidos.
El número de enlaces que forman los átomos
El hidrógeno forma un único enlace, por lo que solamente está unido a un átomo, y siempre está en los extremos de las moléculas.
El oxígeno forma dos enlaces, con dos átomos diferentes o con un único átomo, y entonces el enlace es doble.
El carbono forma cuatro enlaces. En algunos compuestos, dos de ellos son sencillos y uno doble.
Fíjate en los modelos moleculares: el oxígeno puede tener uno o dos vástagos, y el carbono, tres o cuatro, según sea el número de átomos a los que se unen.
Debes construir las moléculas siguientes: HCl, CH4 y NH3.

El número de enlaces que forman los átomos
El hidrógeno forma un único enlace, por lo que solamente está unido a un átomo, y siempre está en los extremos de las moléculas.
El oxígeno forma dos enlaces, con dos átomos diferentes o con un único átomo, y entonces el enlace es doble.